
【题目】高纯活性氧化锌可用于光催化、光电极、彩色显影等领域。以工业级氧化锌(含 Fe2+、Mn2+、Cu2+、Ni2+、Cd2+等)为原料,用硫酸浸出法生产高纯活性氧化锌的工艺流程如下:

回答下列问题:
(1)浸出时,为了提高浸出效率采取的措施有(写两种):__________;
(2)氧化时,加入KMnO4溶液是为了除去浸出液中的Fe2+和Mn2+(溶液中Mn元素全 部转化为MnO2),请配平下列除去Fe2+的离子方程式:
______MnO4-+______Fe2++_____=______MnO2↓+______Fe(OH)3↓+______H+
(3)加入锌粉的目的是_____________________。
(4)已知H2SO4浸出液中,c(Fe2+)=5.04mg/L、c(Mn2+) ="1." 65mg/L。
①加入KMnO4溶液反应一段时间后,溶液中c(Fe3+) ="0." 56 mg/L,若溶液pH=3,则此时Fe3+_________(填“能”或“不能”)发生沉淀。
②若要除尽1m3上述浸出液中的Fe2+和Mn2+,需加入________g KMnO4。
【答案】将工业级氧化锌粉碎 、搅拌 1 3 7H2O 1 3 5 调节溶液pH,除去溶液中的Cu2+、Ni2+、Cd2+等 不能 7.9
【解析】
(1)增大接触可以提高浸出效率,如搅拌、将氧化锌粉碎等;
(2)Mn元素化合价由MnO4-中+7价降低为MnO2中+4价,共降低3价,Fe元素化合价由Fe3+中+2价升高为Fe(OH)3中+1价,共升高1价,化合价升降最小公倍数为3,则MnO4-的系数为1,Fe3+的系数为3,由原子守恒可知缺项为水,再结合原子守恒、电荷守恒配平;
(3)调节溶液pH,除去溶液中Cu2+、Ni2+、Cd2+等;
(4)①溶液中c(Fe3+)=0.56mg.L-1,物质的量浓度为10-5mol/L,溶液pH=3,则溶液中c(OH-)=10-11mol/L,计算浓度积Qc,与溶度积Ksp[Fe(OH)3]=4.0×10-38比较判断;
②Fe2+转化为Fe(OH)3,Mn2+转化为MnO2,根据电子转移守恒计算需要高锰酸钾的物质的量,进而计算需要高锰酸钾的质量。
(1)浸出时,根据影响速率的因素可知:为了提高浸出效率采取的措施有将工业级氧化锌粉碎 、搅拌;
(2)根据氧化还原反应中电子守恒及离子反应中电荷守恒反应前后的各种元素的原子个数相等,可得反应的离子方程式是:1MnO4- + 3Fe2+ + 7H2O = 1MnO2↓ + 3Fe(OH)3↓ + 5H+;
(3)经KMnO4溶液氧化后的溶液中加入锌粉的目的是调节溶液pH,使溶液中的Cu2+、Ni2+、Cd2+等形成金属氢氧化物沉淀而除去;
(4)① 在pH=3和c(Fe3+)= 0.56mg/L的溶液中,由于c(OH-)=1.0×10-11 mol/L、c(Fe3+)=1.0×10—5 mol/L,则c(Fe3+)× c3(OH—)=1.0×10—38<Ksp[Fe(OH)3]=4.0×10—38,故没有Fe(OH)3沉淀;
② 氧化1 m3含c(Fe2+)=5.04 mg/L(即0.09 mmol/L)和c(Mn2+)=5.04 mg/L(即0.03 mmol/L),根据电子守恒有:n(Fe2+)+2n(Mn2+)=3n(MnO4—),即0.09 mol+2×0.03 mol=3n(MnO4—),解得: n(MnO4—)=0.05 mol 即m(KMnO4)=7.90g。


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】利用电导率传感器可绘制电导率曲线图,下图为用0.1mol/LNaOH溶液滴定10mL0.lmol/L盐酸过程中的电导率曲线。下列说法错误的是

A. 电导率传感器能用于判断酸碱中和滴定的终点
B. a、b、c 点的溶液中,离子浓度由大到小顺序为a>b>c
C. d点所示溶液中存在:c(Cl-) +c(OH-) =c(H+) +c(Na+)
D. C点电导率最小是因为此时溶液中导电微粒数目最少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,卤化银(AgX,X=Cl,Br)的2条溶解平衡曲线如图所示,已知AgCl,AgBr的Ksp依次减小,且p(Ag+)=-lgc(Ag+),p(X-)=-lgc(X-),利用pX-pAg的坐标系可表示出AgX的溶度积与溶液中的c(Ag+)和c(X-)的相互关系.下列说法错误的是
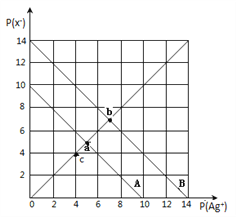
A. t℃时,c点可表示AgCl的不饱和溶液
B. B线表示的是AgBr
C. 取a、b两点处溶液等体积混合,维持t℃不变,混合溶液中一定无白色沉淀生成
D. 在t℃时,AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)平衡常数K≈104
AgBr(s)+Cl-(aq)平衡常数K≈104
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2(g)![]() 2NO(g)+O2(g)在密闭容器中反应,达到平衡状态的标志是( )
2NO(g)+O2(g)在密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时,生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A. ①④⑥B. ②③⑤C. ①③④D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钾的冶炼可采用如下方法:2KF+CaC2![]() CaF2+2K↑+2C,下列有关说法合理的是( )
CaF2+2K↑+2C,下列有关说法合理的是( )
A.该反应的氧化剂是KF,氧化产物是K
B.该反应能说明C的还原性大于K
C.电解KF溶液不可能制备金属钾
D.CaC2、CaF2均为离子化合物,且阴、阳离子个数比均为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.02mol·L—1的HCN溶液与0.02mol·L—1的NaCN溶液等体积混合,已知混合溶液中C(CN-)<C(Na+),则下列关系中,正确的是:
A.C(Na+)>C(CN-)>C( H+)>C(OH-)
B.C(HCN)+C (CN-)=0.04mol·L-1
C.C(CN-)>C(HCN)
D.C(Na+)+C(H+)= C(CN-)+C(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3的水解方程式可写为FeCl3+3H2O![]() Fe(OH)3+3HCl,若提高水解程度采取的方法是 ( )
Fe(OH)3+3HCl,若提高水解程度采取的方法是 ( )
A.降低温度B.加入少量Na2CO3 C.加入少量盐酸D.增加FeCl3的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对水样中溶质M的分解速率影响因素进行研究。在相同温度下,M的物质的量浓度(mol·L-1)随时间(min)变化的有关实验数据见下表。
时间 水样 | 0 | 5 | 10 | 15 | 20 | 25 |
Ⅰ(pH=2) | 0.40 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
Ⅱ(pH=4) | 0.40 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
Ⅲ(pH=4) | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
Ⅳ(pH=4,含Cu2+) | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
下列说法不正确的是
A. 在0~20min内,I中M的分解速率为0.015 mol·L-1·min-1
p>B. 水样酸性越强,M的分解速率越快C. 在0~25min内,III中M的分解百分率比II大
D. 由于Cu2+存在,IV中M的分解速率比I快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度条件下,甲、乙两个容积相等的恒容密闭容器中均发生如下反应:3A(g)+B(g)![]() xC(g)+D(s),向甲中通入6mol A和2mol B,向乙中通入1.5mol A、0.5mol B、3mol C和2mol D,反应一段时间后都达到平衡,此时测得甲、乙两容器中C的体积分数都为20%,下列叙述中不正确的是( )
xC(g)+D(s),向甲中通入6mol A和2mol B,向乙中通入1.5mol A、0.5mol B、3mol C和2mol D,反应一段时间后都达到平衡,此时测得甲、乙两容器中C的体积分数都为20%,下列叙述中不正确的是( )
A.若平衡时,甲、乙两容器中A的物质的量不相等,则x=4
B.平衡时,甲、乙两容器中A、B的物质的量之比相等
C.平衡时甲中A的体积分数为40%
D.若平衡时两容器中的压强不相等,则两容器中压强之比为8:5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com