
【题目】在①178O、1②188O、③2311Na、④2412Mg、⑤146C、⑥147N中:
(1)和互为同位素(填序号,下同);
(2)和的质量数相等,但不能互称同位素;
(3)和的中子数相等,但质子数不等,所以不是同一种元素.
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:
【题目】某课外活动小组将下图所示装置按一定顺序连接,在实验室里制取一定量的FeCl3(所通气体过量并充分反应)。请回答下列问题:
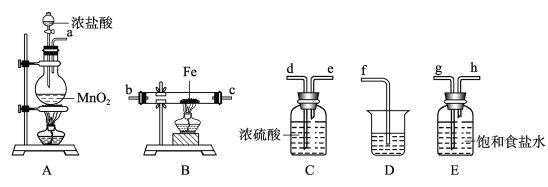
(1)A中发生反应的化学方程式为____________________________。
(2)各装置的正确连接顺序为(填写装置代号)A→_______→_______→_______→D。
(3)装置E的作用是___________________。写出装置D(D中所盛溶液为KOH)中反应的化学方程式___________________
(4)工业上生产氯气的方程式为________________________。
(5)随着反应的进行,发现分液漏斗中的浓盐酸逐渐滴不下去,其原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g) ΔH=Q kJ/mol(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是
Si(s)+4HCl(g) ΔH=Q kJ/mol(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol, 则达平衡时,吸收热量为Q kJ
C.反应至4 min时,若HCl浓度为0. 12 mol/L,则H2的反应速率为0.03 mol/(L·min)
D.当反应吸收热量0.025Q kJ时,生成的HCl通入含0. 1 mol NaOH的溶液恰好反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有几种离子
![]()
己知:铵盐受热易分解,A、B、C、D、E是由它们组成的五种可溶于水的固体(每种离子只能用一次),分别取它们进行实验,结果如下:
①将D与E的溶液混合加热,产生刺激性气味且能使湿润的红色石蕊试纸变蓝的气体;
②将B与E的溶液混合,产生白色沉淀,向该沉淀中加入足量的稀硝酸,沉淀部分溶解;
③向一定量的E溶液中逐滴加入C溶液,先无明显现象,后来产生白色沉淀,且该沉淀可溶于A溶液;
④D固体在一定温度下可以分解为水和另外两种均为空气主要成分的气体单质。
根据上述信息回答下列问题:
(1)根据以上条件推断并写出下列物质的化学式:
A________;B________;C________;D________;E________;
(2)写出A溶液与E溶液恰好完全反应至溶液呈中性的离子方程式___________。
(3)写出D固体分解的化学方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl- 六种粒子。其中N2的物质的量随时间变化的曲线如图所示。下列判断正确的是
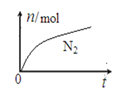
A. 该反应的还原剂是Cl-
B. 消耗1 mol还原剂,转移6 mol电子
C. 氧化剂与还原剂的物质的量之比为2:3
D. 反应后溶液的酸性明显增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】保护环境、保护地球已成为人类共同的呼声。下列措施不利于保护环境的是
A. 积极推广使用新型环保装饰材料
B. 发展清洁煤技术,开展煤的综合利用
C. 控制工业废水和生活污水的排放,改善水体质量
D. 关闭垃圾焚烧处理厂,生活垃圾和工业垃圾全部就地填埋处理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含 SO32-、Fe2+、Br-、I-各 0.1 mol 的溶液中通入标准状况下的 Cl2,通入 Cl2的体积和溶液中相关离子的物质的量的关系图正确的是
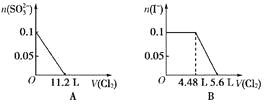
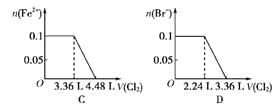
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表的叙述,错误的是( )
A.第IA族元素全部是金属元素
B.过渡元素全是金属元素
C.第ⅦA族元素是同周期中非金属性最强的元素
D.在元素周期表中金属与非金属的分界线附近可以寻找制造半导体的材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】

(1)写出仪器D、E的名称 、 .
(2)分离以下混合物应该主要选用使用什么仪器?(填字母符号)粗盐和泥沙 ;菜籽油和水 。
(3)计算标签上硫酸的物质的量浓度为 。
(4)用18 mol·L-l 浓硫酸配制100 ml 3.0 mol·L-l 稀硫酸的实验步骤如下:① 计算所用浓硫酸的体积;②量取一定体积的浓硫酸;③ 溶解;④ 转移、洗涤;⑤ 定容、摇匀。回答下列问题:

Ⅰ.所需浓硫酸的体积是 ,量取浓硫酸所用的量筒的规格是
(从下列量筒的规格中选用 A 10mL B 20mL C 50mL D 100mL)
Ⅱ.第③步实验的操作是 。
Ⅲ.下列情况对所配制的稀硫酸浓度有何影响?(用偏大、偏小、无影响填写)
A.所用的浓硫酸长时间放置在密封不好的容器中
B.量取浓硫酸时仰视
C.容量瓶用蒸馏洗涤后残留有少量的水
D.所用过的烧杯、玻璃棒未洗涤
(5)浓度不等的两种硫酸溶液等质量混合后,溶液的质量分数为a%,而等体积混合后,溶液的质量分数为b%;浓度不等的两种氨水等质量混合后,其质量分数为a%,而等体积混合后,溶液的质量分数为c%,那么a、b、c数值的关系是( )
A.a>b>c B.b>a>c C.c>b>a D.c>a>b
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com