
【题目】化合物AX3和单质X在一定条件下反应可生成化合物AX3。反应AX3(g)+X2(g)=AX5(g)在容积为10L的密闭容器中进行。起始时AX3和X2均为0.2mol.反应在不同条件下进行,反应体系总压强随时间的变化如图所示。回答下列问题:
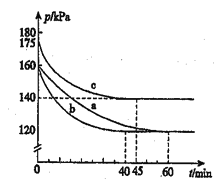
(1)下列式计算实验a从反应开始至达到平衡时的反应速率v(AX5)=_________
(2)图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为____(填实验序号);与实验a相比,b改变的实验条件及判断依据是:_________
(3)用p0表示开始时总压强,p表示平衡时总压强,α表示AX5的平衡转化率,则a的表达式为_______;实验a和c的平衡转化率:αa为______,αc为_______。
【答案】 0.10mol/(10L×60min)=1.7×10-4mol·L-1·min-1 bca b:加入催化剂。反应速率加快,但平衡点没有改变 a=2(1-p/p0) 50% 40%
【解析】(1)依据体积不变的密闭容器中压强之比就等于物质的量之比有,实验a开始时n0=0.4mol,总压强为160kPa,则可列比例式:![]() =
=![]() ,n=0.4mol×
,n=0.4mol×![]() =0.3mol。假设平衡时AX5的物质的量为x,可列式如下:
=0.3mol。假设平衡时AX5的物质的量为x,可列式如下:
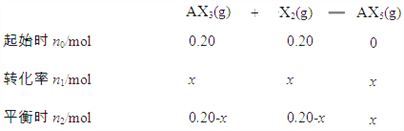
(0.20-x)+(0.20-x)+x=0.3 解得:x=0.1,
v(AX5)=![]() =1.7×10-4mol·L-1·min-1;
=1.7×10-4mol·L-1·min-1;
(2)由图像知,达到平衡所需时间:a>c>b,所以反应速率.v(AX5)由大到小的顺序为b>c>a;与实验a相比,实验b先达到平衡,化学反应速率快,但平衡没有变化,说明实验b加入了催化剂;
(3) 用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,
AX3(g)+ X2(g)![]() AX5(g)
AX5(g)
初始 (mol) 0.20 0.20 0
平衡 (mol) 0.20-x 0.20-x x
(0.20-x)+(0.20-x)+x=n,则x= 0.40-n
αa=50%; αc==40%。


科目:高中化学 来源: 题型:
【题目】在强酸性溶液中,能大量共存的离子组是( )
A. K+、Cu2+、OH﹣、SO42- B. Fe3+、NH4+、NO3-、Cl﹣
C. K+、Na+、Cl﹣、CO32- D. K+、![]() 、MnO4-、SO42-
、MnO4-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于消去反应的是( )
A. 苯与Fe、Br2混合B. 氯乙烷和NaOH溶液共热
C. 乙醇与乙酸反应生成乙酸乙酯D. 乙醇与浓硫酸共热到170℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将一定质量的混合气体在密闭容器中发生反应aA(g) + bB(g) ![]() cC(g) + dD(g),达到平衡时测得B气体的浓度为0.6mol/l,恒温下将密闭容器的容积扩大一倍,重新达到平衡时,测得B气体的浓度为 0.4mol/l,下列叙述中正确的是( )
cC(g) + dD(g),达到平衡时测得B气体的浓度为0.6mol/l,恒温下将密闭容器的容积扩大一倍,重新达到平衡时,测得B气体的浓度为 0.4mol/l,下列叙述中正确的是( )
A. a+b>c+d
B. 平衡向右移动
C. 重新达平衡时,A气体浓度增大
D. 重新达平衡时,B的体积分数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.2 mol KMnO4在一定温度下加热后生成a mol O2;将剩余固体与过量浓盐酸混合加热又生成b mol Cl2,此时锰元素均以Mn2+形式存在。若a+b=m,则m的值可能为( )
A. 0.30 B. 0.35
C. 0.40 D. 0.50
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期主族元素 X、Y、Z、W 的相对位置如表,元素 X 的原子核外电子数是 Z的 2 倍。下列说法不正确的是
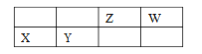
A. W 元素的简单气态氢化物的热稳定性比 Z 元素的简 单气态氢化物的高
B. 气体分子(ZW)2 的结构式为 N≡C—C≡N
C. X、Y、W 三种元素的简单离子半径最大的是 Y
D. 元素 X 位于周期表中第三周期、第ⅡA族,其单质制备可用电解熔融 XCl2 的方法。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下物质之间的每步转化中,都能通过一步实现的是( )
①Fe→FeCl2→Fe(OH)2→ Fe(OH)3
②Na→Na2O→Na2CO3→NaHCO3→NaOH
③Mg→MgCl2→Mg(OH)2
④Al→Al2O3→Al(OH)3
⑤Al→NaAlO2→Na2CO3
A. ②③④ B. ①③④⑤ C. ①②③⑤ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将6.5g锌投入200mL某浓度的盐酸中,锌和盐酸恰好完全反应。求:
(1)写出反应的化学方程式并用双线桥标出电子转移的方向和数目________;
(2) 所用盐酸中HCl的物质的量;____
(3)反应中生成的H2在标准状况下的体积。____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com