
【题目】向含0.78molFeCl2溶液中通入0.09molCl2, 再加入100mL1mol/L的X2O72-酸性溶液,使溶液中的Fe2+恰好全部氧化,则产物中X的化合价为 ( )
A.+3 B.+2 C.+1 D.+5
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:
【题目】下列关于胶体和溶液的说法正确的是
A.胶体区别于其他分散系的本质特征是分散质的微粒直径在1~100nm之间
B.溶液呈电中性,胶体带有电荷
C.溶液中分散质微粒能透过滤纸,胶体中分散质微粒不能透过滤纸
D.制备氢氧化铁胶体时,可以将饱和FeCl3溶液滴入沸水,然后长时间煮沸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表短周期的一部分

(1)①~⑦元素中金属性最强的元素在元素周期表中的位置是___________。
(2)表中元素⑥的原子结构示意图为___________。
(3)④与⑤形成的化合物的化学键类型为_______,该化合物的电子式为____________。
(4)表中元素②、③、⑦最高价含氧酸的酸性由强到弱的顺序是___________(填化学式,下同);④所在主族的前四种元素的单质分别与氢气化合形成的气态氢化物的稳定性由强到弱的顺序是_________。
(5)表中元素②的单质与③的最高价含氧酸反应的化学方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A. Na2O2与H2O反应:2Na2O2+2H2O===4Na++4OH-+O2↑
B. 澄清石灰水中通入少量的CO2:CO2+OH-===HCO![]()
C. Mg(OH)2与盐酸反应:OH-+H+===H2O
D. Zn与AgNO3溶液反应:Zn+Ag+===Zn2++Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。下列叙述正确的是
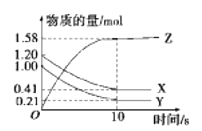
A.反应开始到10 s末时,用Z表示的反应速率为0.158 mol·L-1·s-1
B.反应开始到10 s末时,X的物质的量浓度减少了0.79 mol·L-1
C.反应开始到10 s时,Y的转化率为79.0%
D.反应的化学方程式为X(g)+Y(g)![]() Z(g)
Z(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL某盐酸溶液中逐滴加入0.1mol/L的氨水,溶液pH的变化与加入氨水的体积关系如图所示,下列叙述正确的是

A. 盐酸的物质的量浓度为1mol/L
B. 在①、②之间的任意一点:c(Cl﹣)>c(NH4+),c(H+)>c(OH﹣)
C. 在点③所示溶液中:由水电离出的c(OH﹣)>10﹣7mol/L
D. 在点②所示溶液中:c(NH4+)=c(Cl﹣)>c(OH﹣)=c(H+),且V <20
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在2L恒容密闭容器中气态物质X、Y、Z的物质的量随时间变化的部分数据如表所示:
T/min | n(X) /mol | n(Y) /mol | n(Z) /mol |
0 | 0.80 | 1.00 | 0 |
1 | 0.70 | 0.80 | 0.20 |
5 | 0.70 | ||
9 | 0.40 | ||
10 | 0.40 | 0.80 |
(1)写出该反应的化学方程式_________________
(2)反应进行到10min,X的转化率为___________,0~5min内Y的平均反应速率为___________
(3)计算T℃时该反应的平衡常数K=____________
(4)T℃下向该密闭容器中通入一定量的X、Y、Z,反应到某时刻测得X、Y、Z的物质的量分别为1.00mol、0.50mol、1.60mol,则此时正逆反应速率大小:v正 v逆(填“大于”、“等于”、“小于”)
(5)若在10min和t3、t5时刻分别改变该反应的某一反应条件,得到X、Z的物质的量及反应速率与时间的关系如下图A、B所示:

10min时改变的反应条件是_______________
②t3时刻改变的反应条件是_______________
③t5时刻改变的反应条件是 ,理由是___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在一固定容积的密闭容器中发生反应:A(g)+B(g)![]() C(s)△H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,下列判断正确的是
C(s)△H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,下列判断正确的是

A. T℃时,该反应的平衡常数值为4
B. c点没有达到平衡,此时反应向逆向进行
C. 若c点为平衡点,则此时容器内的温度高于T℃
D. T℃时,直线cd上的点均为平衡状态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com