
【题目】下表是元素周期表短周期的一部分

(1)①~⑦元素中金属性最强的元素在元素周期表中的位置是___________。
(2)表中元素⑥的原子结构示意图为___________。
(3)④与⑤形成的化合物的化学键类型为_______,该化合物的电子式为____________。
(4)表中元素②、③、⑦最高价含氧酸的酸性由强到弱的顺序是___________(填化学式,下同);④所在主族的前四种元素的单质分别与氢气化合形成的气态氢化物的稳定性由强到弱的顺序是_________。
(5)表中元素②的单质与③的最高价含氧酸反应的化学方程式为___________________。
【答案】 第三周期第ⅡA族 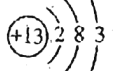 离子键
离子键 ![]() HNO3>H2CO3 >H2SiO3 HF>HCl>HBr>HI C+4HNO3(浓)
HNO3>H2CO3 >H2SiO3 HF>HCl>HBr>HI C+4HNO3(浓) ![]() CO2↑+4NO↑+2H2O
CO2↑+4NO↑+2H2O
【解析】根据元素周期表,①为H元素;②为C元素;③为N元素;④为F元素;⑤为Mg元素;⑥为Al元素;⑦为Si元素;⑧为S元素。
(1)①~⑦元素中金属性最强的元素为镁,在元素周期表中位于第三周期第ⅡA族,故答案为:第三周期第ⅡA族;
(2)表中元素⑥为铝,原子结构示意图为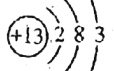 ,故答案为:
,故答案为: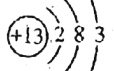 ;
;
(3) ④为F元素;⑤为Mg元素,氟化镁属于离子化合物,含有离子键,电子式为![]() ,故答案为:离子键;
,故答案为:离子键;![]() ;
;
(4)元素的非金属性越强,最高价含氧酸的酸性越强,表中元素②、③、⑦最高价含氧酸的酸性由强到弱的顺序为HNO3>H2CO3 >H2SiO3;④为F元素,元素的非金属性越强,气态氢化物越稳定,则卤素的气态氢化物的稳定性由强到弱的顺序为HF>HCl>HBr>HI,故答案为:HNO3>H2CO3 >H2SiO3;HF>HCl>HBr>HI ;
(5)碳与浓硝酸反应生成二氧化碳、二氧化氮和水,反应的化学方程式为C+4HNO3(浓) ![]() CO2↑+4NO↑+2H2O,故答案为:C+4HNO3(浓)
CO2↑+4NO↑+2H2O,故答案为:C+4HNO3(浓) ![]() CO2↑+4NO↑+2H2O。
CO2↑+4NO↑+2H2O。


科目:高中化学 来源: 题型:
【题目】向一容积不变的密闭容器中充入一定量A和B,发生如下反应:xA(g)+2B(s)![]() yC(g) ΔH<0在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:
yC(g) ΔH<0在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:
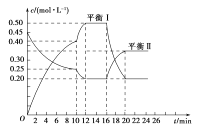
(1)根据图示可确定x∶y=________。
(2)用A的浓度变化表示该反应在0~10 min内的平均反应速率v(A)=______________。
(3)0~10 min容器内压强________(填“变大”、“不变”或“变小”)。
(4)推测第10 min引起曲线变化的反应条件可能是____________;第16 min引起曲线变化的反应条件可能是____________。
①减压 ②增大A的浓度 ③增大C的量 ④升温 ⑤降温 ⑥加催化剂
(5)若平衡Ⅰ的平衡常数为K1,平衡Ⅱ平衡常数为K2,则K1____________K2(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将pH=5的H2SO4的溶液稀释1000倍后,溶液中SO42-离子浓度与H+离子浓度的比值约为
A.1:10 B.1:1 C.1:2 D.1:20
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在 1.01×105Pa、150℃条件下,某烃完全燃烧,反应前后压强不发生变化,该烃可能是( )
A. C2H4 B. C3H8 C. C2H6 D. C2H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提纯下列物质(括号内为杂质),选用的试剂和分离方法不正确的是
物质 | 试剂 | 分离方法 | |
A | 淀粉溶液(NaCl) | 水 | 渗析 |
B | CaCO3(CaO) | 水 | 过滤 |
C | KCl溶液(I2) | 酒精 | 萃取 |
D | CO2(HCl) | 饱和碳酸氢钠溶液 | 洗气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.01 mol·L-1 MOH溶液的pH为10,MOH(aq)与H2SO4(aq)反应生成1 mol正盐的ΔH=-24.2 kJ·mol-1,强酸与强碱的稀溶液的中和热为ΔH=-57.3 kJ·mol-1。则MOH在水溶液中电离的ΔH为
A.-69.4 kJ·mol-1 B.-45.2 kJ·mol-1 C.+69.4 kJ·mol-1 D.+45.2 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含0.78molFeCl2溶液中通入0.09molCl2, 再加入100mL1mol/L的X2O72-酸性溶液,使溶液中的Fe2+恰好全部氧化,则产物中X的化合价为 ( )
A.+3 B.+2 C.+1 D.+5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组以一种工业废料制备高纯MgO,设计了流程如下。

请回答下列问题。
(1)步骤①中生成Mg2+的离子方程式为______________
(2)下列物质可用于代替步骤②中H2O2的是__________
A.NaCl B.Cl2 C.铁粉 D.KMnO4
(3)步骤③中采用如图所示装置除去Fe3+

ⅰ.实验装置图中仪器A的名称为________________
ⅱ.充分振荡并静置分层,打开仪器A上口的玻璃塞后,上、下层分离的正确操作是:________________
ⅲ.图中存在的错误是:________________
(4)步骤④中NaOH加入的量是______________ (填“少量”或“过量”)
(5)实验中,取工业废料40.0g( MgCO3的含量为42%),得到4.0g高纯氧化镁。该实验中高纯氧化镁的产率为____________(![]() )
)
(6)高纯氧化镁可能具有如下性质和用途,正确的是____________
A.耐酸 B.耐碱 C.制耐火坩埚 D.制信号弹和焰火材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com