
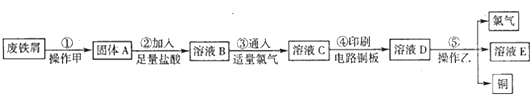
| ||
| ||


科目:高中化学 来源: 题型:
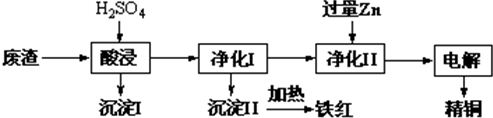
查看答案和解析>>
科目:高中化学 来源: 题型:
 X、Y、R、Z、W是元素周期表前四周期中常见的元素,其相关信息如下表:
X、Y、R、Z、W是元素周期表前四周期中常见的元素,其相关信息如下表:| 元素 | 相关信息 |
| X | X的基态原子L层电子数是K层电子数的2倍 |
| Y | Y的基态原子最外层电子排布式为:nsnnpn+2 |
| R | 在第3周期元素中,R的简单离子半径最小 |
| Z | Z存在质量数为23,中子数为12的核素 |
| W | W有多种化合价,其白色氢氧化合物在空气中会迅速变成灰绿色,最后变成红褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
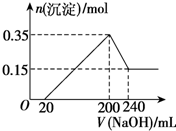
| A、①②⑤ | B、②③④ |
| C、②③⑥ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸馏法 | B、水洗分液法 |
| C、升华法 | D、有机溶剂萃取法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
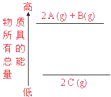 下列说法正确的是( )
下列说法正确的是( )| A、①③⑥ | B、②④⑤ |
| C、①③④ | D、③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
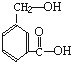 在某有机物A的分子中,具有醇羟基、羧基等官能团,其结构简式如图.
在某有机物A的分子中,具有醇羟基、羧基等官能团,其结构简式如图.查看答案和解析>>
科目:高中化学 来源: 题型:
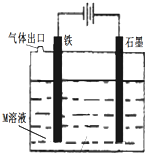
| A、装置中电子移动的途径是:负极→Fe→M溶液→石墨→正极 |
| B、若M为FeCl2溶液,可以实现石墨上镀铁 |
| C、若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀 |
| D、若 M为NaCl溶液,通电段时间后,溶液中可能有NaClO |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、放热183 kJ |
| B、放热91.5 kJ |
| C、吸热183 kJ |
| D、吸热91.5 kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com