
【题目】[化学一一选修5:有机化学基础]愈创木酚(化合物E)是一种重要的精细化工中间体,广泛应用于医药、香料及染料的合成。其合成路线及某种应用如图(部分产物及条件已略去):

已知:①R1X+R2ONa→R1-O-R2+NaX
②![]()
③化合物F能发生水解反应,不能使FeCl3显色
④化合物G可用于水果催熟
(1)C分子中含有的官能团名称为______________________________。
(2)由B生成C的反应类型为______________________________。
(3)D的结构简式为______________________________。
(4)由A 生成B 的化学方程式为______________________________。
(5)F和足量NaOH溶液反应的化学方程式为______________________________。
(6)化合物M比F的相对分子质量小28,同时满足以下条件的M的同分异构体有_______种(不考虑立体异构)。①遇FeCl3溶液显紫色 ②能发生银镜反应
其中核磁共振氢谱峰面积之比为1:1:2:2的M的结构简式为___________(任写一种)。
(7)参照愈创木酚的合成路线格式,设计一条由化合物G为起始原料经三步合成化合物H的合成路线_____________________。(反应条件需全部标出)
【答案】 硝基、醚键 取代反应 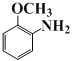
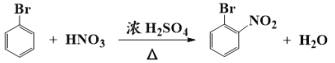
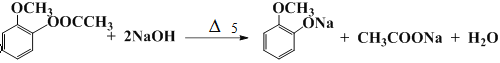 9
9 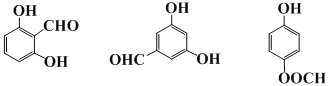
![]()
【解析】(1)由框图推知C的中结构简式为: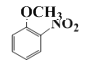 其含有的官能团名称为硝基、醚键。
其含有的官能团名称为硝基、醚键。
(2)由B的结构式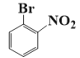 生成C结构式
生成C结构式 的反应类型为
的反应类型为![]() ,
,
由B生成C的反应类型为:取代反应。
(3)由已知![]() 由框图
由框图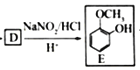 逆推知D的结构简式为
逆推知D的结构简式为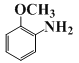
(4)![]() ,由A 的结构
,由A 的结构![]() 的生成B的结构式为
的生成B的结构式为![]() 的化学方程式为
的化学方程式为![]()
(5)由图F结构简式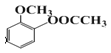 和足量NaOH溶液反应的化学方程式为
和足量NaOH溶液反应的化学方程式为![]()
(6)化合物M比F的相对分子质量小28,同时满足以下条件的M的同分异构体有_______种(不考虑立体异构)。①遇FeCl3溶液显紫色说明苯环含有羟基, ②能发生银镜反应说明有醛基,核磁共振氢谱峰面积之比为1:1:2:2的M的结构简式可能为:
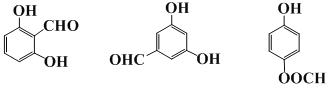
(7)由题意G结构简式CH2=CH2,,愈创木酚的合成路线格式,设计一条由化合物G为起始原料经三步合成化合物H的合成路线![]()


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】碳酸镧能抑制人体内磷酸盐的吸收,降低体内血清磷酸盐和磷酸钙的水平,常用于慢性肾衰患者高磷血症的治疗。某课外小组对碳酸镧的实验室制备进行了探究:
已知:ⅰ.La2(CO3)3难溶于水,易溶于盐酸,溶液pH较高时易生成碱式碳酸镧[La(OH)CO3]。
ⅱ.LaCl3与易溶的碳酸盐或碳酸氢盐反应可制备La2(CO3)3。
(1)甲组同学利用下列装置在实验室中用碳酸氢铵制备碳酸镧。

①仪器X的作用为__________;锥形瓶中可选用的试剂为__________(填化学式)。
②实验中 K1、 K2打开的先后顺序为______________;为保证碳酸镧的纯度,实验过程中需要注意的问题有_____________________。
(2)乙组同学对碳酸钠和碳酸氢钠与氯化镧反应制备碳酸镧进行了探究。
①通过实验发现用碳酸氢钠溶液制备碳酸镧的纯度高,理由是__________ (任写一条)。
②请写出用碳酸氢钠溶液制备碳酸镧的离子方程式_____________________________。
③所制碳酸镧需经洗涤,才能达到医用要求,请写出对碳酸镧沉淀洗涤的方法:
___________________________________________________。
(3)碳酸镧(式量为458)质量分数的测定:准确称取 10.0g 产品试样,溶于10.0mL稀盐酸中,加入10mL NH3-NH4Cl 缓冲溶液,加入 0.2g 紫脲酸铵混合指示剂,用 0.5 mol·L-1EDTA(Na2H2Y)标准溶液滴定至呈蓝紫色(La3++H2Y2-= LaY-+2H+),消耗 EDTA 溶液 40.00mL。则产品中碳酸镧的质量分数 w=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G是几种烃分子的球棍模型(如图),据此回答下列问题: 
(1)常温下含氢量最高的烃是(填对应字母);
(2)能够发生加成反应的烃有(填数字)种;
(3)G与浓硝酸和浓硫酸的混酸共热生成的淡黄色晶体的名称(用系统命名法命名);(不允许写简称)
(4)写出A失去一个氢原子形成的甲基的电子式;
(5)写出F发生溴代反应的化学方程式: .
(6)写出实验室制取D的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于加成反应的是( )
A. CH4+Cl2![]() CH3Cl + HCl
CH3Cl + HCl
B. H2+ Cl2![]() 2HCl
2HCl
C. CH2=CH2+ H2O![]() CH3CH2OH
CH3CH2OH
D. 2NaOH + Cl2=NaClO + NaCl + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度不变恒容的容器中进行反应H2![]() 2H,若反应物浓度由0.1mol·L-1降到0.06mol·L-1需20s,那么由0.06mol·L-1降到0.036mol·L-1所需反应时间应为
2H,若反应物浓度由0.1mol·L-1降到0.06mol·L-1需20s,那么由0.06mol·L-1降到0.036mol·L-1所需反应时间应为
A. 等于10s B. 等于12s C. 大于12s D. 小于12s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏伽德罗常数的数值,下列说法错误的是( )
A.常温常压下,1 mol氦气含有的核外电子数为2NA
B.1.7gCH5+离子中含有的电子总数为NA
C.1molC10H22分子中共价键总数为31 NA
D.1molNO2与足量水反应时共转移2NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】R、Q、X、Y、Z是原子序数依次增大的五种短周期主族元素,R与Q形成的气态化合物的水化物显碱性,X、Y、Z三种元素族序数之和为10,Y单质能与强碱溶液反应,Z元素原子最外层电子数是电子层数的两倍。
(1)Z在周期表中的位置_______________;X、Y、Z三种元素形成的简单离子半径由大到小的顺序是________________________。(用离子符号回答)
(2)X和R两种元素按原子个数比1:1组成的化合物的电子式为____________。
(3)写出Y、Z两种元素最高价氧化物对应的水化物相反应的离子方程式:_____________。
(4)水的沸点远高于Z元素的氢化物的沸点,原因是_________________。
(5)Q4是一种Q元素的新单质,可用作推进剂或炸药,推算其分子中含有_____对共用电子。
(6)由R、Q两元素组成的一种液态化合物W常用作还原剂,W分子中含有18个电子,W分子的结构式为_____________________。W与氢氧化铜悬浊液反应生成氧化亚铜,同时产生一种稳定的气态单质,该反应的化学方程式为_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com