
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
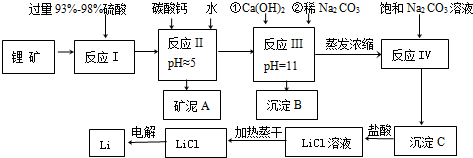
分析 锂矿主要成分为Li2O、Al2O3、SiO2,另含有FeO、MgO、CaO等杂质为原料来制取金属锂,加入过量浓硫酸溶解锂矿,加入碳酸钙除去过量的硫酸调节溶液PH=5,使铁离子和铝离子沉淀完全,加入水洗过滤洗去矿泥,然后加入氢氧化钙和碳酸钠沉淀镁离子和钙离子,过滤得到溶液中主要是锂离子的溶液,蒸发浓缩,加入碳酸钠沉淀锂离子生成碳酸锂,洗涤后加入盐酸溶解得到纯净的氯化锂溶液,加热蒸干得到氯化锂,电解熔融氯化锂得到金属锂.
(1)锂矿中的FeO在反应 I中与浓硫酸发生氧化还原反应,被氧化成硫酸铁,根据元素守恒书写化学反应方程式;
(2)反应 II中要使铝离子和铁离子全部沉淀,而镁离子不能沉淀,根据题中提供的属氢氧化物开始沉淀和完全沉淀时的pH可判断;
(3)反应Ⅲ主要是沉淀镁离子,沉淀C为碳酸锂,其溶解度随温度升高而降低,洗涤时要减少碳酸锂的损失,据此判断;
(4)反应 IV是用碳酸根离子将溶液中的锂离子沉淀,根据电荷守恒和元素守恒书写离子方程式为;
(5)电解熔融LiCl时阴极锂离子得电子生成锂,根据蒸干LiCl溶液时,LiCl有少量水解生成LiOH,氢氧化锂部分分解生成氧化锂,电解时会生成氧气.
解答 解:锂矿主要成分为Li2O、Al2O3、SiO2,另含有FeO、MgO、CaO等杂质为原料来制取金属锂,加入过量浓硫酸溶解锂矿,加入碳酸钙除去过量的硫酸调节溶液PH=5,使铁离子和铝离子沉淀完全,加入水洗过滤洗去矿泥,然后加入氢氧化钙和碳酸钠沉淀镁离子和钙离子,过滤得到溶液中主要是锂离子的溶液,蒸发浓缩,加入碳酸钠沉淀锂离子生成碳酸锂,洗涤后加入盐酸溶解得到纯净的氯化锂溶液,加热蒸干得到氯化锂,电解熔融氯化锂得到金属锂.
(1)锂矿中的FeO在反应 I中与浓硫酸发生氧化还原反应,被氧化成硫酸铁,反应的化学反应方程式为2FeO+4H2SO4(浓)=Fe2(SO4)3+SO2↑+4H2O,
故答案为:2FeO+4H2SO4(浓)=Fe2(SO4)3+SO2↑+4H2O;
(2)反应 II中要使铝离子和铁离子全部沉淀,而镁离子不能沉淀,根据题中提供的属氢氧化物开始沉淀和完全沉淀时的pH可知反应 II中pH的范围是4.7≤pH<9.6,
故答案为:4.7≤pH<9.6;
(3)反应Ⅲ主要是沉淀镁离子,所以沉淀B中主要成分为CaCO3和Mg(OH)2,沉淀C为碳酸锂,其溶解度随温度升高而降低,洗涤时要减少碳酸锂的损失,所以要用热水洗涤,
故答案为:Mg(OH)2;热水;
(4)反应 IV是用碳酸根离子将溶液中的锂离子沉淀,反应的离子方程式为2Li++CO32-=Li2CO3,故答案为:2Li++CO32-=Li2CO3;
(5)电解熔融LiCl时阴极锂离子得电子生成锂,电极反应式为Li++e-=Li,蒸干LiCl溶液时,LiCl有少量水解生成LiOH,氢氧化锂部分分解生成氧化锂,电解时会生成氧气,所以阳极产生的氯气中会混有少量氧气,
故答案为:Li++e-=Li;加热蒸干LiCl溶液时,LiCl有少量水解生成LiOH,受热分解生成Li2O,电解时放电产生O2.
点评 本题考查了工业上以β-锂辉矿制取金属锂的方法,题目难度中等,试题涉及了化学式的书写、物质的分离与提纯、离子方程式的书写等知识,合理分析题中工艺流程是解题关键.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题

| A. | 先通二氧化碳、后通氨气、效果相同 | B. | 生成1mol(NH4)2SO4至少消耗2molNH3 | ||
| C. | CO2可被循环使用 | D. | 往甲中通CO2有利于制备(NH4)2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的 2 mol/L的硫酸于试管 | 反应速率:镁>铁,铜不反应 | 金属的性质越活泼,反应速率越快 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M<N | B. | 2M=N | C. | N<M | D. | M=N |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀硫酸反应制取H2后的溶液中:Na+、K+、AlO2-、Br- | |
| B. | 银氨溶液:Na+、K+、NO3-、NH3•H2O | |
| C. | 苯酚钠溶液:H+、HCO3-、SO2、K+ | |
| D. | 氢氧化铝胶体:H+、K+、S2-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com