
【题目】亚氯酸钠(NaClO2)是重要的漂白剂。某小组开展如下实验,按如图装置制取无水NaClO2晶体,回答下列问题:
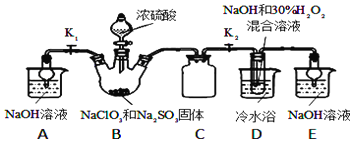
已知:NaClO2饱和溶液在低于38℃时析出NaClO23H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl.
(1)装置C的作用是_________________;
(2)已知装置B中的产物有ClO2气体,则B中反应的方程式为_________________;装置D中反应生成NaClO2的化学方程式为_________________________;
(3)从装置D反应后的溶液中获得无水NaClO2晶体的操作步骤为:①减压,55℃蒸发结晶;②____________;③用38℃~60℃热水________;④在_____________条件下干燥得到成品.
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是_________和____________;
(5)测定样品中NaClO2的纯度.测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2-+4I-+4H+═2H2O+2I2+Cl-,将所得混合液稀释成100mL待测溶液.取25.00mL待测溶液,加入淀粉溶液做指示剂,用c molL-1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2+2S2O32-═2I-+S4O62-).请计算所称取的样品中NaClO2的物质的量为__________.
【答案】防止D瓶溶液倒吸到B瓶中2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2趁热过滤洗涤低于60℃NaClO3NaClcV10﹣3mol .
【解析】
(1)装置D中发生气体反应,装置内压强降低,装置C的作用是安全瓶,防止D瓶溶液倒吸到B瓶中;
(2)装置B中制备得到ClO2,所以B中反应为NaClO3和Na2SO3在浓H2SO4的作用生成 ClO2和Na2SO4;
装置D反应后的溶液获得NaClO2晶体,装置D中生成NaClO2,Cl元素的化合价降低,双氧水应表现还原性,有氧气生成,结合原子守恒可知,还有水生成,配平后方程式为:2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2;
(3)从溶液中制取晶体,一般采用蒸发结晶、过滤、洗涤、干燥的方法,为防止析出晶体NaClO23H2O,应趁热过滤,由题目信息可知,应控制温度38℃~60℃进行洗涤,低于60℃干燥;
(4)由题目信息可知,应控制温度38℃~60℃,高于60℃时NaClO2分解成NaClO3和NaCl,所以如果撤去D中的冷水浴,可能导致产品中混有的杂质是NaClO3和NaCl;
(5)令样品中NaClO2的物质的量x,
NaClO2~2I2~4S2O32-,
1mol 4mol
0.25x c molL-1×V×10-3L
则:x=cV10-3mol
故答案为cV10-3mol;


科目:高中化学 来源: 题型:
【题目】氨硼烷是一种有效、安全的固体储氢材料,氨硼烷的结构和乙烷相似,如下图。

(1)氨硼烷的晶体类型为____________.
(2)氨硼烷分子中氮原子、硼原子的杂化轨道类型分别为 和 .
(3)氨硼烷晶体中存在的作用力有 (填序号)
A离子键 B极性键 C非极性键 D配位键 E金属键 F氢键 G范德华力
(4)硼酸的结构式可表示为 ,请写出硼酸溶于水后溶液显酸性的离子方程式 ________ 。
,请写出硼酸溶于水后溶液显酸性的离子方程式 ________ 。
(5)以NaBH4为硼源、某配合物为氨源可用于制备氨硼烷.为测定该配合物的结构,取2.32g配合物进行如下实验:用重量法分析金属元素,测得镍元素的质量为0.59g;在碱性条件下加热蒸出NH3,用滴定法测出其物质的量为0.06mol;滴加过量硝酸银溶液,有白色沉淀生成,加热,沉淀没有增加;用摩尔法分析含量,测得氯元素质量为0.71g.
①该配合物中镍离子的基态电子排布式为 .
②该配合物的结构简式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(双选)油脂是人体重要的能源物质,下列关于油脂的叙述正确的是( )
A. 油脂的主要成分是高级脂肪酸 B. 油脂属于天然有机高分子化合物
C. 煎炸食物的花生油比牛油的熔点低 D. 油脂可以在碱性条件下水解,用于制取肥皂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在常温下发生水解时,对应的离子方程式正确的是( )
①Na2CO3:CO32-+2H2O![]() H2O+CO2↑+2OH-
H2O+CO2↑+2OH-
②NH4Cl:NH4++H2O![]() NH3·H2O+H+
NH3·H2O+H+
③CuSO4:Cu2++2H2O![]() Cu(OH)2+2H+
Cu(OH)2+2H+
④NaF:F-+H2O![]() HF+OH-
HF+OH-
A.①④ B.②③ C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前全球范围内环境污染备受关注,化工生产中应大力倡导“绿色化学”和“原子经济”的理念,工业生产中的废物利用尤为重要。工业上生产高氯酸时,还同时生产了一种常见的重要含氯消毒剂和漂白剂亚氯酸钠(NaClO2),其工艺流程如下:
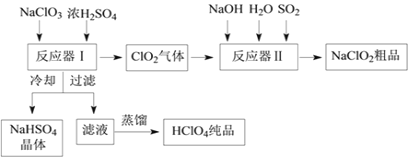
已知:①NaHSO4溶解度随温度的升高而增大,适当条件下可结晶析出。②高氯酸是至今为止人们已知酸中的最强酸,沸点90℃。请回答下列问题:
(1)反应器Ⅰ中发生反应的化学方程式为_______,冷却的目的是____________。
(2)反应器Ⅱ中发生反应的离子方程式为__________________________。
(3)通入反应器Ⅱ中的SO2用H2O2代替同样能生成NaClO2,请简要说明双氧水在反应中能代替SO2的原因是_________________________。
(4)Ca(ClO)2、ClO2、NaClO2等含氯化合物都是常用的消毒剂和漂白剂,请写出工业上用氯气和消石灰生产漂粉精的化学方程式:___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
A. 温度一定时,Ksp(SrSO4)随c(SO42—)的增大而减小
B. 三个不同温度中,313 K时Ksp(SrSO4)最大
C. 283 K时,图中a点对应的溶液是饱和溶液
D. 283 K下的SrSO4饱和溶液升温到363 K后变为不饱和溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的KOH溶液时,导致浓度偏低的原因可能是
A.容量瓶中原有少量的蒸馏水
B.移液时,不慎将液体流到瓶外
C.容量瓶盛过KOH溶液,使用前未洗涤
D.定容时仰视刻度线和液面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氯元素的说法正确的是( )
A. HCl具有很强的酸性,且只有氧化性没有还原性
B. ![]() 、
、![]() 为不同的核素,有完全不同的化学性质
为不同的核素,有完全不同的化学性质
C. 1.12L含有1 .7NA个质子(NA表示阿伏加德罗常数)
D. 氯气可从KI溶液中置换出I2,说明氯的非金属性比碘强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素。下列判断正确的是( )

A. 甲一定是金属元素
B. 气态氢化物的稳定性:庚>己>戊
C. 乙、丙、丁的最高价氧化物水化物可以以相互反应
D. 庚的最高价氧化物水化物酸性最强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com