
【题目】氨硼烷是一种有效、安全的固体储氢材料,氨硼烷的结构和乙烷相似,如下图。

(1)氨硼烷的晶体类型为____________.
(2)氨硼烷分子中氮原子、硼原子的杂化轨道类型分别为 和 .
(3)氨硼烷晶体中存在的作用力有 (填序号)
A离子键 B极性键 C非极性键 D配位键 E金属键 F氢键 G范德华力
(4)硼酸的结构式可表示为 ,请写出硼酸溶于水后溶液显酸性的离子方程式 ________ 。
,请写出硼酸溶于水后溶液显酸性的离子方程式 ________ 。
(5)以NaBH4为硼源、某配合物为氨源可用于制备氨硼烷.为测定该配合物的结构,取2.32g配合物进行如下实验:用重量法分析金属元素,测得镍元素的质量为0.59g;在碱性条件下加热蒸出NH3,用滴定法测出其物质的量为0.06mol;滴加过量硝酸银溶液,有白色沉淀生成,加热,沉淀没有增加;用摩尔法分析含量,测得氯元素质量为0.71g.
①该配合物中镍离子的基态电子排布式为 .
②该配合物的结构简式为 .
【答案】
(1)分子晶体
(2)sp3;sp3;
(3)BDG;
(4)H3BO3+H2O![]() H4BO4+H+;
H4BO4+H+;
(5)①1s22s22p63s23p63d8;②[Ni(NH3)6]Cl2 ;
【解析】
试题分析:(1)氨硼烷的分子结构和乙烷相似,是四面体结构,食欲分子晶体,故答案为:分子晶体;
(2)氨硼烷分子中氮原子、硼原子有三个单电子,它们的杂化轨道类型分别为sp3、sp3,故答案为:sp3;sp3;
(3)根据氨硼烷的结构,晶体中存在极性键和分子间作用力,根据氨硼烷是一种有效、安全的固体储氢材料,晶体中还存在配位键,故选BDG;
(4)硼酸溶于水能够电离,溶液显酸性的离子方程式为H3BO3+H2O![]() H4BO4+H+,故答案为:H3BO3+H2O
H4BO4+H+,故答案为:H3BO3+H2O![]() H4BO4+H+;
H4BO4+H+;
(5)①Ni原子得原子序数是28,离子的基态电子排布式为1s22s22p63s23p63d8,故答案为:1s22s22p63s23p63d8;
②用重量法分析金属元素,测得镍元素的质量为0.59g即0.01mol;在碱性条件下加热蒸出NH3,用滴定法测出其物质的量为0.06mol,即N元素物质的量是0.06mol;用摩尔法分析含量,测得氯元素质量为0.71g,即Cl元素的物质的量是0.01mol,根据质量守恒,H元素质量是0.18g,所以分子中Ni、N、Cl、H的原子个数之比是1:6:2:18,根据配合物的特点,得出分子式为:[Ni(NH3)6]Cl2,故答案为::[Ni(NH3)6]Cl2。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为0.5 L的恒容密闭容器中发生反应:
CO(g)+Cl2(g)![]() COCl2(g)
COCl2(g)
其中容器Ⅰ中5 min时到达平衡。
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
CO | Cl2 | COCl2 | COCl2 | ||
Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
Ⅱ | 500 | 1.0 | a | 0 | 0.5 |
Ⅲ | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
下列说法正确的是
A. 容器Ⅰ中前5 min的平均反应速率v(CO)=0.16 mol·L-1·min-1
B. 该反应的正反应为吸热反应
C. 容器Ⅱ中起始时Cl2的物质的量为0.55 mol
D. 若起始时向容器Ⅰ中加入CO 0.8 mol、Cl2 0.8 mol,达到平衡时CO的转化率大于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)对于反应:2SO2(g)+O2(g) ![]() 2SO3(g);如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)=________________________;υ(SO3)=_______________________。
2SO3(g);如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)=________________________;υ(SO3)=_______________________。
(2)已知:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g) ![]() 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g) ![]() SO3(g)+NO(g)的ΔH=______ kJ·mol-1。
SO3(g)+NO(g)的ΔH=______ kJ·mol-1。
(3)一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是______。
a、体系压强保持不变 b、混合气体颜色保持不变
c、SO3和NO的体积比保持不变 d、每消耗1 mol SO3的同时生成1 mol NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钙是人体必需的常量元素,成年人每天需要800毫克的钙,下列补钙的途径正确的是
A.不经常晒太阳 B.经常饮用牛奶、豆奶
C.经常饮用钙离子含量高的硬水 D.大量补充维生素C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是短周期元素,周期表中A与B、B与C相邻;C与E同主族;A与C最外层电子数之比为2:3,B的最外层电子数比C的最外层电子数少1个; F元素的原子在周期表中半径最小;常见化合物D2C2与水反应生成C的单质,且溶液使酚酞溶液变红。
(1)F的三种核素表示符号为______,E的名称为______,D的最高价氧化物的水化物的电子式:______。
(2)在B、C、D、E、F原子形成的单核离子中离子半径最小的是____,离子半径最大的是____。(填离子符号)
(3)A、B、C的氢化物稳定性顺序为_____(用分子式表示);B的氢化物和B的最高价氧化物的水化物反应生成Z,反应中断裂化学键是_____,形成的化学键是________。(填“离子键”、“极性键”、“非极性键”、“氢键”)
(4)F2C和F2E中,沸点较高的是__________(填化学式),其主要原因是_________。
(5)两种均含C、D、E、F四种元素的化合物相互反应放出气体的反应离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据部分短周期元素的信息回答问题。
元素 | 元素信息 |
A | 第3周期ⅥA族 |
B | 族序数是周期数的3倍 |
C | 原子序数是11 |
D | D3+与Ne的电子数相同 |
(1)A、B的元素符号为________、________,C、D的元素名称为________、________。
(2)写出B、C的常见单质在加热时的反应方程式:________。
(3)从原子结构的角度分析,A原子与B原子的________相同,C原子与D原子的________相同。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是重要的漂白剂。某小组开展如下实验,按如图装置制取无水NaClO2晶体,回答下列问题:
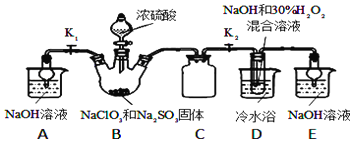
已知:NaClO2饱和溶液在低于38℃时析出NaClO23H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl.
(1)装置C的作用是_________________;
(2)已知装置B中的产物有ClO2气体,则B中反应的方程式为_________________;装置D中反应生成NaClO2的化学方程式为_________________________;
(3)从装置D反应后的溶液中获得无水NaClO2晶体的操作步骤为:①减压,55℃蒸发结晶;②____________;③用38℃~60℃热水________;④在_____________条件下干燥得到成品.
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是_________和____________;
(5)测定样品中NaClO2的纯度.测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2-+4I-+4H+═2H2O+2I2+Cl-,将所得混合液稀释成100mL待测溶液.取25.00mL待测溶液,加入淀粉溶液做指示剂,用c molL-1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2+2S2O32-═2I-+S4O62-).请计算所称取的样品中NaClO2的物质的量为__________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com