
【题目】下列各组反应中关于能量的比较正确的是( )
①H2(g)+Cl2(g)=2HCl(g)△H1; ![]() H2(g)+
H2(g)+ ![]() Cl2(g)=HCl (g)△H2;△H1>△H2
Cl2(g)=HCl (g)△H2;△H1>△H2
②2H2O(l)=2H2(g)+O2(g)△H1; 2Na(s)+2H2O(l)=2NaOH(aq)+H2(g)△H2;△H1>△H2
③CH3OH(g)+ ![]() O2(g)=CO2(g)+2H2O(l)△H1;CH3OH(l)+
O2(g)=CO2(g)+2H2O(l)△H1;CH3OH(l)+ ![]() O2(g)=CO2(g)+2H2O(g)△H2;△H1<△H2
O2(g)=CO2(g)+2H2O(g)△H2;△H1<△H2
④t℃时,在一定条件下,将 1mol N2和 3mol H2 分别置于恒容和恒压的两个密闭容器中,达到平衡状态时放出的热量分别为 Q1、Q2; Q1<Q2 .
A.①③④
B.①②④
C.②③④
D.①③
【答案】C
【解析】解:①反应热的大小与物质的量成正比,所以物质的量越多放出的热量越多,值越小,则△H1<△H2 , 故错误;②2H2O(l)=2H2(g)+O2(g)分解反应是吸热反应,所以△H1>0,而活泼金属与水的反应是放热反应,所以△H2<0,所以;△H1>△H2 , 故正确;
③气态的甲醇转化为液态的甲醇要放热,由反应Ⅰ、CH3OH(g)+ ![]() O2(g)=CO2(g)+2H2O(l)△H1;ⅡCH3OH(l)+
O2(g)=CO2(g)+2H2O(l)△H1;ⅡCH3OH(l)+ ![]() O2(g)=CO2(g)+2H2O(g)△H2;根据盖斯定律Ⅰ﹣Ⅱ得:CH3OH(g)=CH3OH(l),△H1﹣△H2<0,所以△H1<△H2 , 故正确;
O2(g)=CO2(g)+2H2O(g)△H2;根据盖斯定律Ⅰ﹣Ⅱ得:CH3OH(g)=CH3OH(l),△H1﹣△H2<0,所以△H1<△H2 , 故正确;
④合成氨正反应是气体体积减小的反应,所以恒压达平衡时的体积小于恒容的体积,所以恒容相当于在恒压的基础上减小压强,平衡逆向移动,则恒容放出的热量少,所以Q1<Q2 , 故正确;
故选C.
【考点精析】本题主要考查了反应热和焓变的相关知识点,需要掌握在化学反应中放出或吸收的热量,通常叫反应热才能正确解答此题.


科目:高中化学 来源: 题型:
【题目】速力菲(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
![]()
试回答下列问题:
(1)试剂1是______________,试剂2是_______________,加入新制氯水后溶液中发生的离子反应方程式是___________________________________________,_____________________________________;
(2)加入试剂2后溶液颜色由淡黄色转变为淡红色的原因可能是:_____________________。
(3)该同学猜想血红色溶液变为无色溶液的原因是溶液中的+3价铁被还原为+2价铁,你认为该同学的猜想合理吗?_______________。若你认为合理,请说明理由(若你认为不合理,该空不要作答) ;若你认为不合理请提出你的猜想并设计一个简单的实验加以验证(若你认为合理,该空不要作答)________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属加工后的废切削液中含2%~3%的NaNO2,它是一种环境污染物,人们用NH4Cl溶液来处理废切削液,使NaNO2转化为无毒物质,该反应分两步进行:
第一步:NaNO2+NH4Cl=NaCl+NH4NO2
第二步:NH4NO2=N2↑+2H2O
下列对第二步反应的叙述中正确的是
①NH4NO2只是氧化剂 ②NH4NO2只是还原剂
③NH4NO2发生了分解反应 ④只有氮元素的化合价发生了变化
⑤NH4NO2既是氧化剂又是还原剂
A. ①③ B. ①④ C. ②③④ D. ③④⑤
【答案】D
【解析】本题考查氧化还原反应的基本概念。第二步反应中NH4NO2发生了自身的氧化还原反应,其中氮元素发生了归中反应,NH4NO2既是氧化剂又是还原剂,从四大基本反应类型看,NH4NO2发生的是分解反应,所以③④⑤是正确的。故D选项符合题意。
【题型】单选题
【结束】
16
【题目】下图表示AlCl3溶液与NaOH溶液相互滴加混合,由图中判断错误的是( )
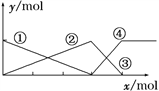
A. ①线表示Al3+物质的量的变化
B. x表示AlCl3的物质的量
C. ③线表示Al(OH)3物质的量的变化
D. ④线表示AlO![]() 物质的量的变化
物质的量的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,将A和B各0.32mol充入恒容密闭容器中,发生反应:A(g)+B(g)2C(g)△H=﹣a kJmol﹣1(a>0),反应过程中测定的数据如表,下列说法正确的是( )
t/min | 0 | 2 | 4 | 7 | 9 |
n(B)/mol | 0.32 | 0.24 | 0.22 | 0.20 | 0.20 |
A.若起始时向容器中充入0.64 mol C,则达平衡时吸收的热量为0.12a kJ
B.恒温,如果压缩容器体积,B的浓度和体积分数均不变
C.若起始时向容器中充入 0.64 mol A 和 0.64 mol B,则达平衡时 n(C)<0.48 mol
D.恒温、恒容,向平衡体系中再充入0.32 mol A,再次平衡时,B的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】充分利用已有的数据是解决化学问题方法的重要途径.对数据的利用情况正确的是
A.利用化学平衡常数判断化学反应进行的快慢
B.利用溶解度数据判断氧化还原反应发生的可能性
C.利用沸点数据推测将一些液体混合物分离的可能性
D.利用物质的摩尔质量判断相同状态下不同物质密度的大小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组微粒在指定溶液中可能大量共存的是( )
A.0.1 mol/L FeCl3溶液:K+、Br﹣、H2O2
B.含大量NO3﹣的溶液:Fe2+、SO42﹣、H+
C.水电离产生的c(OH﹣)=10﹣13mol/L的溶液:Al3+、Na+、Cl﹣
D.![]() =1×1014的溶液:NH4+、CrO42﹣、ClO﹣
=1×1014的溶液:NH4+、CrO42﹣、ClO﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,Ksp[Mg(OH)2]=1.1×10﹣11 , Ksp(AgCl)=1.8×10﹣10 , Ksp(Ag2CrO4)=1.9×10﹣12Ksp(CH3COOAg)=2.3×10﹣3 , 下列叙述不正确的是( )
A.浓度均为0.2 molL﹣1的AgNO3溶液和CH3COONa溶液等体积混合一定产生CH3COOAg沉淀
B.将0.001 molL﹣1的AgNO3溶液滴入0.001 molL﹣1的KCl和0.001 molL﹣1的K2CrO4的混合溶液中,先产生Ag2CrO4沉淀
C.c(Mg2+)为0.11 molL﹣1的溶液中要产生Mg(OH)2沉淀,溶液的pH要控制在9以上
D.在其他条件不变的情况下,向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com