
【题目】速力菲(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
![]()
试回答下列问题:
(1)试剂1是______________,试剂2是_______________,加入新制氯水后溶液中发生的离子反应方程式是___________________________________________,_____________________________________;
(2)加入试剂2后溶液颜色由淡黄色转变为淡红色的原因可能是:_____________________。
(3)该同学猜想血红色溶液变为无色溶液的原因是溶液中的+3价铁被还原为+2价铁,你认为该同学的猜想合理吗?_______________。若你认为合理,请说明理由(若你认为不合理,该空不要作答) ;若你认为不合理请提出你的猜想并设计一个简单的实验加以验证(若你认为合理,该空不要作答)________________________。
【答案】 稀盐酸 KSCN溶液 2Fe2++C12=2Fe3++2C1- Fe3++SCN-=Fe(SCN)3 少量的Fe2+转化为Fe3+,加入KSCN后显淡红色 不合理 我的猜想是Fe(SCN)3中的SCN-被过量的氯水氧化。设计的实验为在褪色后溶液加入FeCl3溶液,仍不变红色(或在褪色后溶液加入加入KSCN溶液,变红色)
【解析】(1)试剂1用于溶解样品,可以选用稀盐酸;用于部分亚铁离子被空气中的氧气氧化成铁离子,所以加入KSCN溶液后,在未加新制氯水的情况下,溶液中也产生了红色,
加入新制氯水后溶液中发生的离子反应方程式为:2Fe2++C12=2Fe3++2C1-、Fe3++SCN-=Fe(SCN)3;(2)加入试剂2后溶液颜色由淡黄色转变为淡红色的原因可能是:少量的Fe2+转化为Fe3+,加入KSCN后显淡红色;(3)该同学猜想血红色溶液变为无色溶液的原因是溶液中的+3价铁被还原为+2价铁,猜想不合理,我的猜想是Fe(SCN)3中的SCN-被过量的氯水氧化。设计的实验为在褪色后溶液加入FeCl3溶液,仍不变红色(或在褪色后溶液加入加入KSCN溶液,变红色)。


 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】到目前为止,由化学能转变的热能或电能仍然是人类使用最主要的能源.
(1)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.已知:H2(g)+Cl2(g)=2HCl(g)△H=﹣a kJmol﹣1;E(H﹣H)=b kJmol﹣1 , E(Cl﹣Cl)=c kJmol﹣1 , 则:E(H﹣Cl)=;
(2)氯原子对O3的分解有催化作用:O3(g)+Cl(g)=ClO(g)+O2(g)△H1 , ClO(g)+O(g)=Cl(g)+O2(g)△H2 , 大气臭氧层的分解反应是O3+O=2O2△H.该反应的能量变化示意图如图1所示.则反应O3(g)+O(g)=2O2(g)的正反应的活化能为kJmol﹣1 . 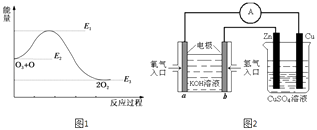
(3)实验中不能直接测出由石墨和氢气反应生成甲烷反应的反应热,但可测出CH4、石墨和H2燃烧反应的反应热,求由石墨生成甲烷的反应热.已知:
①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣a kJmol﹣1
②C(石墨)+O2(g)═CO2(g)△H=﹣b kJmol﹣1
③H2(g)+ ![]() O2(g)═H2O(l)△H=﹣c kJmol﹣1
O2(g)═H2O(l)△H=﹣c kJmol﹣1
则反应C(石墨)+2H2(g)→CH4(g)的反应热:
△H=kJmol﹣1 .
又已知:该反应为放热反应,△H﹣T△S可作为反应方向的判据,当△H﹣T△S<0时可自发进行;则该反应在什么条件下可自发进行 . (填“低温”、“高温”)
(4)有图2所示的装置,该装置中Cu极为极;当铜片的质量变化为12.8g时,a极上消耗的O2在标准状况下的体积为L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有大量下列离子:Fe3+、SO42-、Al3+和M离子,且这四种离子Fe3+、SO42-、Al3+和M的物质的量之比为2:4:1:1,则M离子可能为下列中的( )
A.Na+B.I-C.S2-D.Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有三种短周期主族元素aX,bY,cZ.已知a+c=2b,若Z的最高价氧化物对应的水化物是中学常见的强酸,则下列有关说法中正确的是( )
A.若X为O,则Y,X形成的常见化合物一定是离子化合物
B.若X是Na,则Z的最高正价一定是偶数
C.若Y为O,则非金属性:X<Y<Z
D.若Y为Na,则X,Z不可能是同一主族元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明某烃分子里只含有一个碳碳双键的事实是( )
A. 该烃分子里碳氢原子个数比为1:2
B. 该烃能使酸性KMnO4溶液褪色
C. 该烃完全燃烧生成的CO2和H2O的物质的量相等
D. 该烃容易与溴水发生加成反应,且1mol该烃完全加成消耗1mol溴单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠、钾的碘化物在生产和科学实验中有十分重要的应用.工业利用碘、NaOH和铁屑为原料可生产碘化钠,其生产流程如图1: 
(1)NaOH溶液和碘反应时需要严格控制温度,如果温度过低,会生成碘的低价副产品NaIO.若NaOH溶液和碘反应时所得溶液中IO3﹣与IO﹣的物质的量之比为1:1,则该反应的离子方程式为 .
(2)生产流程中加入过量铁屑的目的是 , 过滤所得固体中除剩余铁屑外,还有红褐色固体,则加入铁屑时发生反应的化学方程式是 .
(3)溶液2中除含有H+外,一定含有的阳离子是;试设计实验证实该金属阳离子的存在 .
(4)溶液2经一系列转化可以得到草酸亚铁晶体(FeC2O42H2O),称取3.60g草酸亚铁晶体(相对分子质量是180)用热重法对其进行热分解,得到剩余固体的质量随温度变化的曲线如图2所示:分析图中数据,根据信息写出过程Ⅰ发生2的化学方程式 .
②300℃时剩余固体只有一种且是铁的氧化物,试通过计算确定该氧化物的化学式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙、丙、丁四种金属,将它们分别投入到相同的稀盐酸中,只有丙、丁的表面有气泡产生,且丙产生的气泡比丁快;再将乙投入到甲的盐酸液中,乙的表面有甲析出.则四种金属的活动性顺序正确的是( )
A.甲>乙>丙>丁
B.丙>丁>乙>甲
C.丙>丁>甲>乙
D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组反应中关于能量的比较正确的是( )
①H2(g)+Cl2(g)=2HCl(g)△H1; ![]() H2(g)+
H2(g)+ ![]() Cl2(g)=HCl (g)△H2;△H1>△H2
Cl2(g)=HCl (g)△H2;△H1>△H2
②2H2O(l)=2H2(g)+O2(g)△H1; 2Na(s)+2H2O(l)=2NaOH(aq)+H2(g)△H2;△H1>△H2
③CH3OH(g)+ ![]() O2(g)=CO2(g)+2H2O(l)△H1;CH3OH(l)+
O2(g)=CO2(g)+2H2O(l)△H1;CH3OH(l)+ ![]() O2(g)=CO2(g)+2H2O(g)△H2;△H1<△H2
O2(g)=CO2(g)+2H2O(g)△H2;△H1<△H2
④t℃时,在一定条件下,将 1mol N2和 3mol H2 分别置于恒容和恒压的两个密闭容器中,达到平衡状态时放出的热量分别为 Q1、Q2; Q1<Q2 .
A.①③④
B.①②④
C.②③④
D.①③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com