
����Ŀ��������ĵ�ض������ʽ��е�⣬����a��b��c��d��e��f�缫��Ϊ���Ե缫��ͨ���a���������������Զ���b����2���Ӻ���ҳص�pHΪ12����

�ٵ�ԴA����_____����
��c���ϵĵ缫��Ӧʽ��_____��
�ۼס������ع����ռ���_____mol������
�ܱ�װ����ij������������___�ˣ���Һ��pHΪ___�����£���������Һ����仯����
�ݵ��n���Ӻ�����ͭ���������꣬�ٽ�e��f�缫���ӵ�Դ����ͬ���ĵ����ٵ��n���ӣ������Һ�е�����ͭ�����ʵ���Ũ��Ϊ_____mol/L����������Һ����仯����
���𰸡� �� 2H++2e��=H 2�� 3.5��10��3 0.064 2 0.1
���������ټ׳�ʵ�����ǵ��ˮ��������������������������������������������a���������������Զ���b����˵��a�������ӷŵ�����������b�����������ӷŵ���������������A���Ǹ�������c������������ˮ������������ӷŵ磬�����������缫��ӦʽΪ2H++2e��=H 2������2���Ӻ���ҳص�pHΪ12�������������Ƶ����ʵ���Ϊ��0.01mol/L��0.2L=2��10��3mol��������·ת�Ƶ��ӵ���ĿΪ2��10��3mol�����ҳ���������������ʵ���Ϊ2��10��3mol�����������������ʵ���֮��Ϊ��1.5��10��3mol����������������ʵ�Ϊ3.5��10��3��������ͭ�����ʵ���Ϊ��1��10��3mol������Ϊ��0.064g�����������ӵ����ʵ���Ϊ��2��10��3mol�����������ӵ�Ũ��Ϊ��0.002mol��0.2L =0.01mol/L������Һ��pHΪ2���ݵ��n���Ӻ�����ͭ���������꣬�ٽ�e��f�缫���ӵ�Դ����ͬ���ĵ����ٵ��n���ӣ�˵��ת�Ƶ��ӵ����ʵ�����ȣ���������䣬˵������ͭ�����ʵ���Ũ��Ϊ0.1mol/L��


 ��������ϵ�д�
��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����÷�Һ©�����з����һ��������
A. ���Ȼ�̼�͵� B. ���ͺ�ֲ����
C. �ƾ���ˮ D. ���Ȼ�̼��ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ�������ܱ������н��з�Ӧ:2SO2 (g)+O2(g)![]() 2SO3(g)����H<0�����и�ͼ��ʾ��������������ʱ,�ı�ijһ������������Ӧ��Ӱ��,���з�����ȷ���ǣ� ��
2SO3(g)����H<0�����и�ͼ��ʾ��������������ʱ,�ı�ijһ������������Ӧ��Ӱ��,���з�����ȷ���ǣ� ��

A. ͼ����ʾ�¶ȶԻ�ѧƽ���Ӱ��,�Ҽ��¶Ƚϸ�
B. ͼ����ʾt0ʱ��ʹ�ô����Է�Ӧ���ʵ�Ӱ��
C. ͼ����ʾt0ʱ������O2��Ũ�ȶԷ�Ӧ���ʵ�Ӱ��
D. ͼ����a��b��c������ֻ��b���Ѿ��ﵽ��ѧƽ��״̬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����(����)
A. ����ѹǿ,�����������,��ѧ��Ӧ����һ������
B. �����¶�,����Ӱٷ�����һ������,��ѧ��Ӧ����һ������
C. ����Ӽ��������ķ��Ӽ����ײΪ��Ч��ײ
D. ʹ�ô���,�����˷�Ӧ�Ļ��,�����˻���Ӱٷ���,��ѧ��Ӧ����һ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��һ�ֳ������ĺ�����������ӵı���ģ�ͣ����ڸ����ʵ�˵����ȷ���ǣ� �� 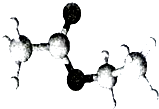
A.��ɫ��ζ��������ˮ��Һ��
B.�������ԣ���ʹʯ����Һ���
C.�����ǻ����������Na��Ӧ
D.�����������ܷ���ˮ�ⷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л���Ӧ�Ļ�ѧ����ʽ��д��ȷ�ǣ� ��
A.CH4+Cl2 ![]() CH2Cl2+H2
CH2Cl2+H2
B.2 ![]() +Br2
+Br2 ![]() 2
2 ![]()
C.CH3CH2OH+O2 ![]() CH3CHO+H2O
CH3CHO+H2O
D.CH3COOH+CH3CH2OH ![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ҫ����������������Ҫ�ɻ�ѧ�仯��������
A.���ٶ�ͨ�緢������B.����ȼ�շų�������
C.ˮ��վ����ˮ�������ĵ���D.���ͨ�緢��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ����������ͨ��30mLŨ��Ϊ10.00mol/L����������Ũ��Һ�У���������ʱ���ǡ����ȫ��Ӧ����Һ���γ�NaCl��NaClO��NaClO3������ϵ�������жϲ���ȷ���ǣ� ��
A. n(Na+):n(Cl-)����Ϊ14:11
B. ��NaOH��Ӧ������һ��Ϊ0.15mol
C. ����Ӧ��ת�Ƶĵ���Ϊnmol����0.15��n��0.25
D. n(NaCl):n(NaClO):n(NaClO3)����Ϊ11:1:2
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com