





科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
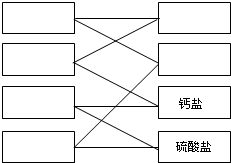
查看答案和解析>>
科目:高中化学 来源: 题型:
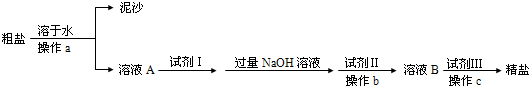
(共13分)粗食盐中除含有CaCl2、MgCl2、Na2SO4等可溶性杂质外,还含有泥砂等不溶性杂质。我们食用的精盐是用粗食盐提纯而得到的。已知:Mg(OH)2难溶于水,BaCO3难溶于水但可溶于盐酸,BaSO4既难溶于水又难溶于酸。
 某同学设计了一种制备精盐的实验方案,步骤如下(每次用于沉淀的试剂均过量)
某同学设计了一种制备精盐的实验方案,步骤如下(每次用于沉淀的试剂均过量)
⑴粗盐的提纯,使用的主要仪器,合理的组合有
①漏斗、②烧杯、③蒸发皿、④酒精灯、⑤量筒、⑥试管夹、⑦玻璃棒、⑧集气瓶
A.①②③④⑦ B.①②③④⑤
C.①②③⑥⑧ D.②③④⑦⑧
⑵如何运用最简方法检验溶液中有无SO42-离子,所用试剂 溶液。如何检验SO42-离子是否除净简单操作为
⑶除去粗食盐中镁离子所用试剂为 溶液。
化学反应方程式
⑷请用化学反应方程式表示第④步中,加入过量Na2CO3溶液的作用:
⑸实验室进行NaCl溶液蒸发时,一般有以下操作过程:①放置酒精灯,②固定铁圈位置,③放上蒸发皿(蒸发皿中盛有NaCl溶液),④加热搅拌,⑤停止加热
其正确的操作顺序为 。当出现 时就可以停止加热。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年四川省成都市望子成龙学校高一(上)期末化学模拟试卷(解析版) 题型:解答题
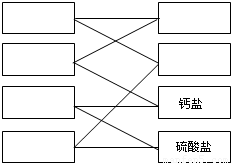

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com