
����Ŀ���״���һ����Ҫ�Ŀ�������Դ��
��1����֪2CH4(g)+O2(g)=2CO(g)+4H2(g) ��H =a kJ��mol-1
CO(g)+2H2(g)=CH3OH(g) ��H =b kJ��mol-1
��д����CH4��O2��ȡ�״����Ȼ�ѧ����ʽ ��
��2������ͨ�����з�Ӧ�Ƽ״���CO(g)+2H2(g)![]() CH3OH(g)����ͼ�Ƿ�ӦʱCO��CH3OH(g)��Ũ����ʱ��ı仯������ӷ�Ӧ��ʼ����ƽ�⣬��H2��ʾ��Ӧ������(H2)= ��
CH3OH(g)����ͼ�Ƿ�ӦʱCO��CH3OH(g)��Ũ����ʱ��ı仯������ӷ�Ӧ��ʼ����ƽ�⣬��H2��ʾ��Ӧ������(H2)= ��
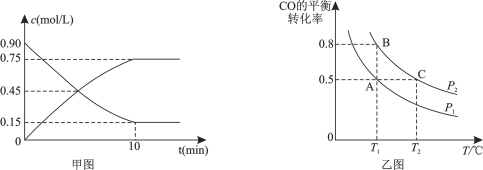
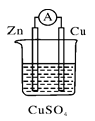
��3����һ�ݻ��ɱ���ܱ������г���10 mol CO��20 mol H2��CO��ƽ��ת�������¶ȣ�T����ѹǿ��P���ı仯����ͼ��ʾ��
������˵�����жϸ÷�Ӧ�ﵽ��ѧƽ��״̬����_______������ĸ����
A��H2���������ʵ���CH3OH���������ʵ�2��
B��H2������������ٸı�
C����ϵ��H2��ת���ʺ�CO��ת�������
D����ϵ�������ƽ��Ħ���������ٸı�
���Ƚ�A��B����ѹǿ��СPA________PB��������������=������
�����ﵽ��ѧƽ��״̬Aʱ�����������Ϊ20 L�������Ӧ��ʼʱ�Գ���10 molCO��20 molH2������ƽ��״̬Bʱ���������V(B)= L��
��4���Լ״�Ϊȼ�ϣ�����Ϊ��������KOH��ҺΪ�������Һ�����Ƴ�ȼ�ϵ�أ��缫����Ϊ���Ե缫����
����KOH��Һ��������д�����������Ӧʽ________________________��
�����������Һ��KOH�����ʵ���Ϊ0.8 mol������0.5 mol�״����뷴Ӧʱ���������Һ�и������ӵ����ʵ���Ũ���ɴ�С��˳���� ��
���𰸡���1��2CH4(g)+O2(g)=2CH3OH(g)����H=(a+2b) kJ��mol-1
��2��0.15mol��L-1��min-1
��3����BD������4
��4����CH3OH+8OH- -6e-=![]() +6H2O��c(K+)��c(
+6H2O��c(K+)��c(![]() )��c(
)��c(![]() )��c(OH-)��c(H+)
)��c(OH-)��c(H+)
��������
���������
��1����֪��2CH4(g)+O2(g)=2CO(g)+4H2(g)����H=a KJ/mol ��CO(g)+2H2(g)=CH3OH(g)����H=b KJ/mol��
��+�ڡ�2�ɵõ�2CH4(g)+O2(g)=2CH3OH(g)����H=��a+2b��kJ/mol
��2���ü״���ʾ�ķ�Ӧ������(CH3OH)=![]() =0.075mol/��Lmin����������ʾ�ķ�Ӧ�����Ǽ״���2��������(H2)=0.15mol/��Lmin����
=0.075mol/��Lmin����������ʾ�ķ�Ӧ�����Ǽ״���2��������(H2)=0.15mol/��Lmin����
��3����A����ΪH2�Ƿ�Ӧ��״���������Ҷ�������֮��Ϊ2:1����������ƽ�����Ӧ������
H2����������ʼ������CH3OH���������ʵ�2������A����B��H2������������ٸı��ǻ�ѧ
ƽ����������ﵽ��ƽ��״̬����B��ȷ��C����Ϊ��ϵ�������H2��CO�����ʵ���֮��Ϊ2: 1��
���ߵļ�����֮��Ϊ2:1��������Ӧ��ת����ʼ����ȣ�����˵����Ӧһ��ƽ�⣬��C����D����
ϵ�������ƽ��Ħ�������������������������������ʵ����ı�ֵ�����������䣬��Ӧʱ��������
������С�����Ե���ϵ�������ƽ��Ħ���������ٸı�ʱ��֤����Ӧ�ﵽ��ƽ�⣬��D��ȷ��
������Ӧ����Ϊ���������С�ķ���T1��ʱ�Ƚ�CO��ת���ʣ�ת����Խ����ѹǿԽ��ͼ����
PBת���ʴ���PA����֪PA��PB��
��A��B�������¶���ͬ������ѧƽ�ⳣ����ȣ�����A��ʱCO��ת����Ϊ0.5�������ݻ�Ϊ20L��
�ɼ����ƽ�ⳣ��K= =4��B��ʱCO��ת����Ϊ0.8����
=4��B��ʱCO��ת����Ϊ0.8����
CO(g)+2H2(g) ![]() CH3OH(g)
CH3OH(g)
��ʼ��mol���� 10 20 0
ת����mol���� 8 16 8
ƽ�⣨mol���� 2 4 8
�����ΪVL������K= =4��V=4��
=4��V=4��
��4����ȼ�ϵ���ܷ�Ӧ��ȼ��ȼ�յĻ�ѧ����ʽ���ڼ��Ի����£�������̼ת��Ϊ̼������ӣ���
2CH3OH+3O2+4OH-=2![]() +6H2O����صĸ����Ǽ״�ʧȥ�����������Ĺ��̣�CH3OH+8OH--6e-
+6H2O����صĸ����Ǽ״�ʧȥ�����������Ĺ��̣�CH3OH+8OH--6e-
=![]() +6H2O
+6H2O
�ڵ���0.5mol�״����뷴Ӧʱ�������Ķ�����̼��0.5mol����0.8mol�������ط�Ӧ������Ԫ���غ�
���Լ���n (K2CO3)=0.3mol��n (KHCO3)=0.2mol�����ߵ�ˮ��Һ��Ϊ���ԣ�����c(K+)��c(CO![]() )��
)��
c (HCO![]() )��c (OH
)��c (OH![]() )��c (H+)��
)��c (H+)��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������
��1)��֪����1 mol C-H, O=O,C=O,H-O��ѧ�����������ֱ�Ϊa KJ��bKJ��cKJ��dKJ����÷�ӦCH4 + O2 = CO2 + 2H2O �ķ�Ӧ��Ϊ��H�� kJ��mol��1
��2��N2H4��һ�ָ�Ч���Ļ��ȼ�ϣ�0.25 mol N2H4(g)��ȫȼ�����ɵ�������̬ˮʱ���ų�133.5 kJ��������÷�Ӧ���Ȼ�ѧ����ʽ�� ��
![]() ��3��ijԪ�ص�һ�ֺ���X��������ΪA������N�����ӣ���ag 1HmX������������������
��3��ijԪ�ص�һ�ֺ���X��������ΪA������N�����ӣ���ag 1HmX������������������
��4���ԱȽ��������馤H�Ĵ�С(�>������<������)
A��A(g)��B(g) = C(g) ��H1<0 A(g)��B(g) = C(l) ��H2<0 ��H1____��H2
B��S(g)��O2(g) = SO2(g)��H1<0 S (s)��O2(g) = SO2(g) ��H2<0 ��H1____��H2
C��C(s)��O2(g) = CO2(g)��H1<0 C(s)��O2(g) = CO(g) ��H2<0 ��H1____��H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������һ��������̫�ս�����ļ���װ�ã���̫�����ɼ������ڷֽ⺣ˮ���������䷴Ӧʽ�ɱ�ʾΪ��![]() �������м���˵������ˮ�ķֽⷴӦ�Ƿ��ȷ�Ӧ����������һ����Դ����ʹ��������ȼ�������ڿ�������ЧӦ�����ù��̽�����ת��Ϊ��ѧ�ܣ�������������ȷ����
�������м���˵������ˮ�ķֽⷴӦ�Ƿ��ȷ�Ӧ����������һ����Դ����ʹ��������ȼ�������ڿ�������ЧӦ�����ù��̽�����ת��Ϊ��ѧ�ܣ�������������ȷ����
A���٢� B���ڢ� C���ۢ� D���٢ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
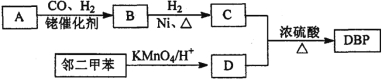
����Ŀ����������ͼ��ʾ��ԭ��أ�����˵����ȷ����( )��
A��������п�缫ͨ������������ͭ�缫
B��п�缫������ԭ��Ӧ��ͭ�缫����������Ӧ
C������13 g Zn�ܽ�ʱ������·�о���0.4 mol����ͨ��
D��ͭ�缫�������������ĵ缫��ӦΪ2H����2e��===H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѡ�����л���DBP��������ά����֬�;�����ϩ�����ܼ����ر�������������ά��Ϳ�ϡ������������ܽ��ԡ���ɢ�Ժ�ճ���ԡ����л���A���ڶ��ױ�Ϊԭ�Ͽ��Ժϳ�DBP��
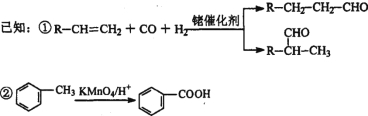
����A���л��ϳɵ���Ҫԭ�ϡ�A������ͼ���m/zΪ42��������ױ��������к���̼̼˫����B�ܷ���������Ӧ���л���C�ĺ˴Ź���������ʾ������к���5�ֻ�ѧ������ͬ����ԭ�ӣ��Ҹ���֮��Ϊ3��2��2��2��l��
�ش��������⣺
��1��A�Ľṹ��ʽΪ________��A��һ�����������ɾۺ���Ļ�ѧ����ʽΪ_______________��
��2��D�еĺ�����������___________���л���D�������л���C��Ӧ����DBP�Ļ�ѧ����ʽ��____________________________________________��
��3������˵����ȷ����___________ ��ѡ�������ĸ����
A��A�ܷ����ۺϷ�Ӧ���ӳɷ�Ӧ��������Ӧ
B����C��Ϊͬ���칹�壬�Һ�����ͬ�����ŵ���������2��
C���ڶ��ױ�����������D˵���л�������л���֮�����Ӱ��
D��1 mol DBP���뺬4mol NaOH����Һ��ȫ��Ӧ
��4����ҵ�ϳ����л���E��C8H4O3������D����DBP����Ӧ��Ϊ�������У�
i��E+C![]() ���� ii������+C
���� ii������+C ![]() DBP+H2O
DBP+H2O
����²�E�Ľṹ��ʽ___________��[
����ҵ�������л���E�ķ�Ӧ���£�2X+9O2![]() 2E+4CO2+4H2O��������X��һ�����ֻ�����֡�X�Ľṹ��ʽ��________��
2E+4CO2+4H2O��������X��һ�����ֻ�����֡�X�Ľṹ��ʽ��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z����Ԫ�ص����Ӷ����ԭ�Ӿ�����ͬ�ĵ��Ӳ��Ų���XԪ�ص�������������ȼ�գ�������ɫ���棻YԪ���⻯��ķ���ʽ��H2Y������������ﺬ��40%��Y��ZԪ�ص����Ӿ�����ɫ����ɫ��Ӧ��
��1�����������������ƶ�Ԫ�����ƣ�X:_____��Y��_____��Z:________��
��2��X��Y��Z����������Ӧ��ˮ�����������ǿ������˳����________��
��3���õ���ʽ��ʾZ2Y���γɹ��̣�___________���仯�����л�ѧ����������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ṹ��ѡ��������B��������Al��������Ga������������Ԫ�����ڢ�A���������ǵĻ�������ʶ�����Ҫ��;���ش��������⣺
��1��д����̬��ԭ�ӵĵ����Ų�ʽ ��
��2����֪����ˮ�Ȼ�����178�����������������ǵϵ�˫������Al2Cl6���������¶���Al2Cl6���������A1Cl3�����ӡ�
�ٹ����Ȼ����ľ��������� ��
��д��Al2Cl6���ӵĽṹʽ ��
�۵�����A1Cl3�����幹���� ����˫����
Al2Cl6��Alԭ�ӵĹ���ӻ������� ��
��3��������Ľṹ��Ԫ������ʮ���壬ÿ����Ԫ����12����ԭ������ͼ����������������ԭ��Ϊ10 B������Ϊ11B����ýṹ��Ԫ�� �ֲ�ͬ�Ľṹ���͡�
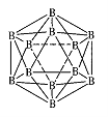
��4����������������ϵ���侧���߳�Ϊ405 pm���ܶ���2��70g��cm��3������ȷ���侧���������������Ļ����������� �������о����������ԭ�ӿɿ����ǽӴ��ģ���ʽ��������ԭ�Ӱ뾶r��A1��= pm��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
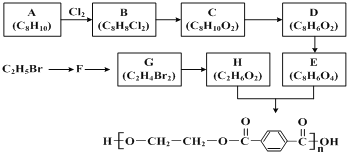
����Ŀ���ϳɵ��ڵ�����ͼ������ʾ��
�ش��������⣺
��1��B �й����ŵ�������___________________��G��������________________��
��2��C��D �ķ�Ӧ������________________��
��3��E�� H ��Ӧ�Ļ�ѧ����ʽΪ________________��
��4������˵����ȷ����_______________��
A��������D�ܷ���������Ӧ
B��������A��D�����ڷ�����
C����ӦG��H������ȥ��Ӧ
D��������D����3molH2�����ӳɷ�Ӧ
E��������C��H��E����������Ʒ�Ӧ�ų�����
��5��E�ж���ͬ���칹�壬��������������ͬ���칹����_______�֣������ں˴Ź��������г�����������__________________________________(д���ṹ��ʽ)��
�������廯��������������ʾ�����Ȼ������ܷ���������Ӧ�����ܷ���ˮ�ⷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����15g�����������Ļ�����м���150mLϡH2SO4�ų�����1.68L(��״��)������Ӧֹͣ����������������ʣ�࣬����Һ����Fe3+���ڡ�Ϊ���к���H2SO4����ʹFe2+��ȫת��ΪFe(OH)2������������3 mol/L NaOH��Һ200mL����
��1�����������������Ϊ g
��2��ϡH2SO4�����ʵ���Ũ��Ϊ mol��L-1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com