
【题目】已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如图所示,下列说法正确的是( )

A. 加入催化剂,减小了反应的热效应
B. 该反应的热化学方程式:2H2O2(l)===2H2O(l)+O2(g) ΔH>0
C. 双氧水催化分解不需要加热,由此推测,催化剂存在下的分解都不需要加热
D. 该反应的反应物总能量高于生成物总能量
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
【题目】芳香族化合物C的分子式为C9H9OCl.C分子中有一个甲基且苯环上只有一条侧链;一定条件下C能发生银镜反应;C与其他物质之间的转化如图所示:
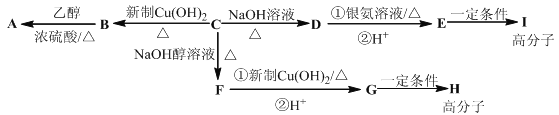
(1)F中含氧官能团的名称是 ,B→A的反应类型是 ;
(2)C的结构简式是 ,H的结构简式是 ;
(3)写出下列化学方程式:①D与银氨溶液反应 ;②E→I .
(4)D的一种同系物W(分子式为C8H8O2)有多种同分异构体,则符合以下条件W的同分异构体有 种,写出其中核磁共振氢谱有4个峰的结构简式 .
①属于芳香族化合物
②遇FeCl3溶液不变紫色
③能与NaOH溶液发生反应但不属于水解反应.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍及其化合物用途广泛。某矿渣的土要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,如图是从该矿渣中回收NiSO4的工艺路线:

已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4,NiFe2O4在焙烧过程中
生成NiSO4、Fe2(SO4)3。锡(Sn)位子第五周期第IVA族.
(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是________________。
(2)"浸泡“过程中Fe2(SO4)3生成FeO(OH)的离子方程式为__________,“浸渣”的成分除Fe2O3、FeO(OH)外还含有____________ (填化学式)。
(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入SnCl2将 Fe3+还原为Fe2+ ,所需SnCl2的物质的量不少于Fe3+物质的量的_____倍;除去过量的SnCl2后,再用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+ ,还原产物为Cr3+,滴定时反应的离子方程式________________。
⑷“浸出液”中c(Ca2+) =1.0×10-3mol·L-1,当除钙率达到99%时,溶液中c(F-)=______mol·L-1。[己知Ksp(CaF2) > 4.0×10-11]
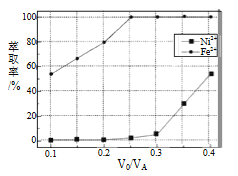
(5)本工艺中,萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值是__________。
(6)己知正十二烷可用作该工艺的萃取剂。用电化学制备正十二烷的方法为:向烧杯中加入50mL甲醇,不断搅拌加入少量金属钠,再加入11mL正庚酸搅拌均匀,装好铂电极,接通电源反应,当电流明显减小时切断电源,然后提纯正十二烷。己知电解总反应为:
2C6H13COONa + 2CH3OH![]() C12H26 + 2CO2↑+H2↑+2CH3ONa
C12H26 + 2CO2↑+H2↑+2CH3ONa
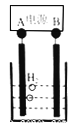
下列说法正确的是(_____)
A.图中电源的A极为直流电源的负极
B.加入金属钠可以将酸转化为钠盐,提高离子浓度,增强导电性
C.阳极电极反应为:2C6H13COO--2e- =C12H26+2CO2↑
D.反应一段时间后将电源正负极反接,会产生杂质影响正十二烷的制备
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验是化学研究的基础,下列实验设计原理正确的是

A. 装置①:可用于吸收NH3,并防止倒吸
B. 装置②:验证溴乙烷发生消去反应生成烯烃
C. 装置③:观察原电池装置中电流表指针偏转
D. 装置④:由实验现象推知酸性强弱顺序为CH3COOH>H2CO3>C6H5OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:

据此判断:
(1)固体B所含物质的化学式为___________________________________________。
(2)固体E所含物质的化学式为__________________________________。
(3)反应①的离子方程式为________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学做“硫在氧气中燃烧”的实验时,老师建议在集气瓶底部放少量NaOH溶液吸收生成的SO2。这种做法引起了同学们的思考:SO2与NaOH是否发生反应。
【查阅资料】通常状况下,1体积水约能溶解40体积SO2。
【实验方案】同学们向充满SO2的软塑料瓶中迅速倒入一定量NaOH溶液,拧紧瓶盖,振荡,发现塑
料瓶变瘪,他们认为SO2与NaOH发生了反应。
【反思与改进】甲同学认为上述实验不够严谨,理由是_________________。于是同学们设计了如下两
个改进方案。
方案一:
实验操作 | 实验现象 |
向两个充满SO2的200 mL软塑料瓶中分别注入10 mL水和NaOH溶液,振荡,对比。 | 两个瓶子变瘪的程度完全相同 |
乙同学认为由于两个瓶子变瘪的程度完全相同,因此无法证明SO2与NaOH是否发生了反应。试分析导致两个瓶子变瘪的程度完全相同的原因是_____________________。他认为若改变注入水和NaOH溶液的体积便可达到实验目的,注入液体的体积可以是__________(填序号)。
a.15 mL b.8 mL c.5 mL d.3 mL
方案二:
实验操作 | 实验现象 |
利用如图所示装置进行实验: 向两个充满SO2的300 mL集气瓶 中分别加入6 mL水和NaOH溶液, 一段时间后,打开止水夹,对比。
| 倒吸入两个集气瓶中的液体体积完全相同 |
丙同学认为上述方案也无法证明SO2与NaOH是否发生反应。你认为导致吸入液体的体积完全相同的原因是___________________。
丁同学思考后,将上述装置进行了改进,便达到实验目的。改进装置如下图所示,你认为装置B的作用是_______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学实验的叙述中,正确的是( )
A. 蒸馏操作时应将温度计的水银球插入液面下
B. 制乙酸乙酯时,将乙醇沿器壁注入浓硫酸中
C. NaOH溶液可以保存在带橡胶塞的试剂瓶中
D. 用溶解、过滤的方法除去粗盐中的氯化钙和氯化镁等杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修5:有机化学基础】
聚芳酯(PAR)在航空航天等领域具有广泛应用。下图是合成某聚芳酯的路线:

已知:
(1)A的名称为______________________,B的结构简式是_________________________。
(2)D的分子式为_______________________,反应④的反应类型是________________。
(3)写出⑤的化学方程式为_________________________。
(4)M是符合下列条件的B的同分异构体
a.能发生银镜反应、水解反应,还能与Na2CO3溶液反应
b.苯环上只有两个取代基且无“—O—O—”结构
c.能与FeCl3发生显色反应
则M共有_______种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】建构数学模型来研究化学问题,既直观又简洁。下列建构的数轴模型正确的是
A. 钠在氧气中燃烧后得到的氧化产物:![]()
B. 铁在Cl2中燃烧后得到的氧化产物:![]()
C. FeBr2溶液中通入Cl2,铁元素存在形式:![]()
D. NH3与Cl2反应,反应产物:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com