
【题目】实验是化学研究的基础,下列实验设计原理正确的是

A. 装置①:可用于吸收NH3,并防止倒吸
B. 装置②:验证溴乙烷发生消去反应生成烯烃
C. 装置③:观察原电池装置中电流表指针偏转
D. 装置④:由实验现象推知酸性强弱顺序为CH3COOH>H2CO3>C6H5OH
科目:高中化学 来源: 题型:
【题目】电镀废液的综合利用有利于减少重金属对水体的污染。某实验小组用以下流程模拟利用一定量工业电镀废液(强酸性,含Cr2O72-、杂质Cu2+等)制备水溶性皮革鞣剂Cr(OH)SO4。回答下列问题:
(已知lg2=0.3,Ksp[ Cr(OH)3]=6.4×10-31, Ksp[ Cu(OH)2]=2×10-20 )

(1)加Na2SO3前先将废液调为弱酸性溶液的原因是__________________,写出废液中加Na2SO3时发生反应的离子方程式_____________。
(2)步骤①须保持温度在30~50℃,可采用的措施是___________________。
(3)步骤②的操作名称是___________。
(4)若在步骤②中,使Cr3+完全沉淀,则溶液的pH范围为______________,
[已知溶液中c(Cu2+)=2×10-4mol·L-1,完全沉淀时c(Cr3+)<10-5 mol·L-1]
(5)粗产品中含有微量CrO42-,工业选择的试剂X应满足的条件是__________。
A.与水互不相溶 B.CrO42-在X中溶解度小
C.Cr(OH)SO4在X中溶解度大 D.Cr(OH)SO4与X不反应
(6)若工业电镀废液含0.1mol Cr2O72-,最终制得产品31.35g,则产率为__________。
(7)酸性条件下,蔗糖还原Na2Cr2O7也可制备Cr(OH)SO4:
Na2Cr2O7+NaHSO4+C12H22O11→Cr(OH)SO4+Na2SO4+H2O+CO2(未配平)
①反应中每生成1molCr(OH)SO4,理论上需要C12H22O11_________mol
②将生成液降温至17℃以下,静置,过滤,在80℃时蒸发滤液,得到标准的工业产品,该产品中混有的主要杂质是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用100 mL 0.500 mol·L-1的NaOH溶液捕获CO2,一定时间后,测定CO2的吸收量。方法是用盐酸逐滴加入到吸收CO2后的溶液中,产生的CO2气体的物质的量与加入盐酸的体积示意图如下:

求:(1)吸收的CO2在标准状况下的体积是________ mL。
(2)盐酸的物质的量浓度是________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如图所示,下列说法正确的是( )

A. 加入催化剂,减小了反应的热效应
B. 该反应的热化学方程式:2H2O2(l)===2H2O(l)+O2(g) ΔH>0
C. 双氧水催化分解不需要加热,由此推测,催化剂存在下的分解都不需要加热
D. 该反应的反应物总能量高于生成物总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物,平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到纯净的CeO2和硫酸铁铵晶体。
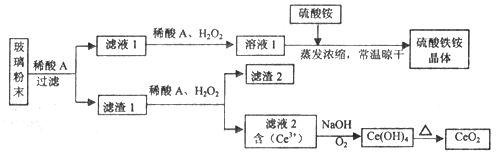
已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液。
(1)稀酸A的分子式是_____________________。
(2)滤液1中加入H2O2溶液的目的是__________________。
(3)设计实验证明滤液1中含有Fe2+_____________________。
(4)已知Fe2+溶液可以和难溶于水的FeO(OH)反应生成Fe3O4,书写该反应的离子方程式____________。
(5)由滤液2生成Ce(OH)4的离子方程式__________________。
(6)硫酸铁铵晶体[Fe2(SO4)3·2(NH4)2SO4·3H2O]广泛用于水的净化处理,但其在去除酸性废水中的悬浮物时效率降低,其原因是___________________。
(7)取上述流程中得到的Ce(OH)4产品0.531 g,加硫酸溶解后,用浓度为0.l000mol·L-1FeSO 4标准溶液滴定至终点时(铈被还原为Ce3+ ),消耗25.00 mL标准溶液。该产品中Ce(OH)4的质置分数为_______(结果保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活、社会密切相关。下列有关说法错误的是
A. 用高纯单质硅制得的光导纤维,可提高信息传输速度
B. 碳纤维是一种新型高强度的无机非金属材料
C. 研制高性能的耐磨轮胎,可在一定程度上减少PM2.5等细颗粒物的产生
D. 开发由二氧化碳制成的全降解塑料,可缓解日益严重的“白色污染”
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com