
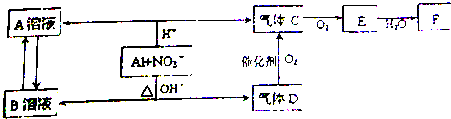
分析 金属铝在酸性或碱性溶液中均可与NO3-发生氧化还原反应,由转化关系图可知,在酸性环境下,反应生成铝盐和一氧化氮,碱性环境下生成偏铝酸盐和氨气,氨气催化氧化可以生成一氧化氮和水,一氧化氮可以和氧气反应生成二氧化氮,故A为硝酸铝,B为偏铝酸盐,C为NO,D为氨气,E为二氧化氮,F为硝酸,然后结合元素化合物性质及化学用语来解答.
解答 解:金属铝在酸性或碱性溶液中均可与NO3-发生氧化还原反应,由转化关系图可知,在酸性环境下,反应生成铝盐和一氧化氮,碱性环境下生成偏铝酸盐和氨气,氨气催化氧化可以生成一氧化氮和水,一氧化氮可以和氧气反应生成二氧化氮,故A为硝酸铝,B为偏铝酸盐,C为NO,D为氨气,E为二氧化氮,F为硝酸.
(1)铝盐与偏铝酸盐发生水解反应反应生氢氧化铝沉淀,反应的离子方程式为:3AlO2-+6H2O+Al3+=4Al(OH)3↓,
故答案为:3AlO2-+6H2O+Al3+=4Al(OH)3↓;
H2O+Al3+=Al(OH)3↓+3NH4+;
(2)氨气可以和一氧化氮或是二氧化氮发生氧化还原反应生成无毒气体单质为氮气,与二氧化碳反应的化学方程式为:8NH3+6NO2$\frac{\underline{\;催化剂\;}}{\;}$7N2+12H2O,
故答案为:8NH3+6NO2$\frac{\underline{\;催化剂\;}}{\;}$7N2+12H2O;
(3)金属铝在碱性环境下可以和硝酸根反应生成偏铝酸盐和氨气,离子方程式为:8Al+3NO3-+5OH-+2H2O=8AlO2-+3NH3↑,
故答案为:8Al+3NO3-+5OH-+2H2O=8AlO2-+3NH3↑;
(4)除去气体NO杂质气体NO2的化学方法用方程式表示为:3 NO2+H2O=2HNO3+NO,
故答案为:3 NO2+H2O=2HNO3+NO;
(5)Al与NO3-在酸性条件下反应生成铝盐、NO,反应离子方程式为:Al+NO3-+4H+=Al3++NO↑+2H2O,Al与被还原的NO3-的物质的量之比是1:1,
故答案为:1:1.
点评 本题考查无机物的推断,侧重化学用语、Al及其化合物转化的考查,注意根据连续发生氧化反应进行推断,难度中等.


科目:高中化学 来源: 题型:解答题
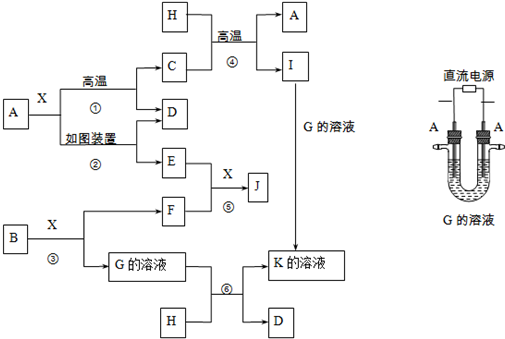
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ④ | C. | ②③ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
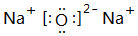 、
、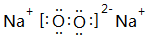 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
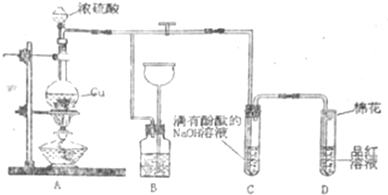
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L盐酸和0.1mol/L醋酸分别与0.2mol/L氢氧化钠溶液反应的速率相同 | |
| B. | 0.1mol/L盐酸和0.1mol/L硝酸分别与大小相同的大理石反应的速率相同 | |
| C. | 铝和铁分别与0.1mol/L硫酸的反应速率相同 | |
| D. | 大理石块与大理石粉末分别与0.1mol/L盐酸反应的速率相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 价层电子对互斥理论将分子分成两类:中心原子有孤电子对的和无孤电子对的 | |
| B. | 价层电子对互斥理论既适用于单质分子,也适用于化合物分子 | |
| C. | sp3杂化轨道是由一个原子中能量相近的s轨道和p轨道通过杂化形成的一组能量相近的新轨道 | |
| D. | AB2型共价化合物的中心原子A采取的杂化方式可能不同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com