
【题目】下列物质中不属于合金的是( )
A. 水银 B. 黄铜 C. 碳素钢 D. 青铜
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】30mlCO2和NO混合气体通入足量的Na2O2固体并且充分反应后,气体体积变为20ml,则原混合气体中CO2体积为(同温同压下) ( )
A. 30mL B. 20mL C. 10mL D. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从古至今,铁及其化合物在人类生产生活中的作用发生了巨大变化。
(1)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是______(填字母序号)。
a.Fe b.FeO c.Fe3O4 d.Fe2O3
(2)硫酸渣的主要化学成分为:SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。用该废渣制取药用辅料——红氧化铁的工艺流程如下(部分操作和条件略):
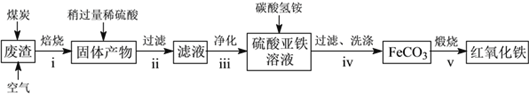
回答下列问题:
①在步骤i中产生的有毒气体可能有__________________。
②在步骤iii操作中,要除去的离子之一为Al3+。若常温时Ksp[Al(OH)3]=1.0×10-32,此时理论上将Al3+沉淀完全,则溶液的pH为____________。
③步骤iv中,生成FeCO3的离子方程式是_________________。
(3)氯化铁溶液称为化学试剂中的“多面手”,向氯化铜和氯化铁的混合溶液中加入氧化铜粉末会产生新的沉淀,写出该沉淀的化学式_________________。请用平衡移动的原理,结合必要的离子方程式,对此现象作出解释:___________________。
(4)①古老而神奇的蓝色染料普鲁士蓝的合成方法如下:

复分解反应ii的离子方程式是________________。
②如今基于普鲁士蓝合成原理可检测食品中CN-,方案如下:
![]()
若试纸变蓝则证明食品中含有CN-,请解释检测时试纸中FeSO4的作用:
_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸根RO3﹣所含电子数比硝酸根离子(NO3﹣)的电子数多10,下列说法中正确的是( )
A.R是第三周期元素
B.R元素的最高正价与N元素最高正价相同
C.RO3﹣和NO3﹣均只能被还原,不能被氧化
D.R和N两元素的单质都是空气的主要成分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】凤凰石是一种用于建材装饰的硅酸盐矿物,已知某地出产的凤凰石可看作由主要成分硅酸铜盐X·3H2O(摩尔质量=334g/mol)与含氧酸盐杂质Y共同组成,X、Y均含三种元素,工业上利用下列流程制备铜盐,在溶液Ⅱ中滴入KSCN溶液显血红色。

请回答:
(1)杂质Y中除氧以外还含有的元素为_____(填元素符号),x的化学式为_______。
(2)如果王溶液Ⅱ中继续加入H2O2,发现有气泡产生,有观点认为是Y中的某元素离子将H2O2氧化所导致,写出反应的离子方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、恒容的密闭容器中进行反应A(g)═B(g)+C(g),若反应物的浓度由2molL﹣1降到0.8molL﹣1需要20s,那么反应物浓度再由0.8molL﹣1降到0.2molL﹣1所需要的时间为( )
A. 10 s B. 大于10 s C. 小于10 s D. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,V升容器中加入a mol HI使之分解:2HI(g) ![]() H2(g)+I2(g),反应达到平衡状态后,下列推测正确的是( )
H2(g)+I2(g),反应达到平衡状态后,下列推测正确的是( )
A. 减压时,v(逆)增大,v(正)减小,平衡向逆反应方向移动
B. 若加入2a mol HI,则平衡常数变为2倍
C. 加压时,v(逆)、v(正)均不变,平衡不移动
D. 若保持压强不变,通入氦气,则v(逆)、v(正)均减小,平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有含NH3为1.7mg/L的废水3.00×105 L(密度为1g/cm3),第一步是微生物在O2充足的条件下,将NH3氧化为HNO3;第二步是加入甲醇(CH3OH,其中C的化合价为-2),还原HNO3,此反应化学方程式为:6NO3- + 6H+ + 5CH3OH→ 3N2↑ + 5CO2↑ + 13H2O
请完成下列填空:
(1)写出第一步反应的化学方程式,并标出电子转移方向和数目:______________。
(2)氨气分子的空间形状是___________________________________;
(3)将Cu投入足量浓HNO3中,产生的现象是____________________、_____________________、
________________________________。
(4)上述在第二步反应中,氧化产物的电子式为________________。若反应中得到17.92L标况下的气体,该反应中转移电子数为_____________________________。
(5)处理上述废水,至少需要甲醇的质量是_____________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2014年7月和12月山西大学分子科学研究所翟华金教授、李思殿教授与清华大学李隽教授、美国布朗大学Lai-Sheng Wang教授及复旦大学刘智攀教授课题组合作,首次合成“中国红灯笼分子”——硼球烯B40。B40是继C60之后第二个从实验和理论上完全确认的无机非金属笼状团簇。

(1) 基态硼原子的外围电子排布式为___________,碳60中碳原子杂化方式为____________。
(2)构成碳60晶体的作用力是___________________。
⑶与硼同周期但第一电离能比硼大的元素有___________种。
(4)磷化硼(BP)是由硼元素与磷元素组成的无机化合物,属于一种半导体材料。磷化硼可由三溴化硼和三溴化磷在氢气中高温反应合成。BP晶胞中B采用面心立方堆积,P原子填入四面体空隙中。
①写出三溴化硼和三溴化磷的空间构型:
三溴化硼__________;三溴化磷____________。
②磷化硼晶体内微粒间的作用力有__________。
③计算磷化硼中硼原子和磷原子之间的最近距离(晶胞参数为478pm)____________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com