
【题目】下列说法正确的是( )
A.需要加热才能发生的反应一定是吸热反应
B.化学反应中的能量变化都表现为热量变化
C.任何放热反应在常温下一定能发生反应
D.反应物和生成物所具有的总能量决定了反应是放热还是吸热
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】格利雅试剂简称“格氏试剂”,它是卤代烃与金属镁在无水乙醚中作用得到的,它可与羰基发生加成反应,如: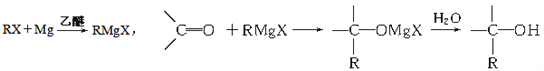
今欲通过上述反应合成2-丙醇,选用的有机原料正确的一组是
A. 氯乙烷和甲醛 B. 氯乙烷和丙醛
C. 一氯甲烷和丙酮 D. 一氯甲烷和乙醛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施对增大反应速率明显有效的是( )
A.Na与水反应时增大水的用量
B.Fe与稀硫酸反应制取H2时,该用浓硫酸
C.在K2SO4与BaCl2两溶液反应时,增大压强
D.Al在氧气中燃烧生成A12O3 , 将Al片改成Al粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中金属硫化物之间存在原电池反应。下图所示装置中电极Ⅰ为方铅矿(PbS),电极Ⅱ为含有方铅矿的硫铁矿,当有电解质溶液按如图所示方向流经该装置时,电流表指针偏转。若电极Ⅱ质量不断减少,a处溶液中加入KSCN溶液未出现红色,加入CuSO4溶液未出现黑色沉淀。下列有关说法中正确的是( )
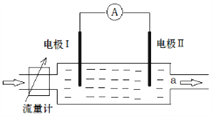
A.工业上利用该原理富集铁
B.电极Ⅱ作正极
C.溶液流经该装置后pH增大
D.该装置负极的电极反应为FeS2—15e—+8H2O=Fe3++2SO42—+16H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂排放的工业废水中主要含Na+、HSO3ˉ、SO42-,研究小组欲测定其中HSO3ˉ的浓度,设计如下三个方案。
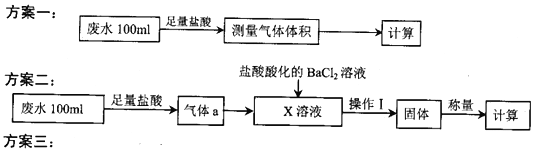
量取20.00mL废水试样,用0.02moL·K-1MnO4标准溶液进行滴定。记录数据,计算。
回答下列问题
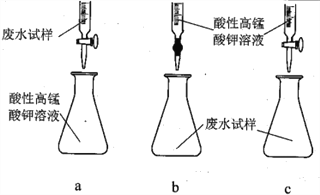
(1)利用右图所示的装置完成方案一
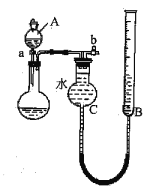
①仪器A的名称是______________。
②读数前,应进行的操作是____________________________。
③该方案存在较大的误差,可能的一种原因是____________________________。
(2)①方案二中吸收气体a的“X溶液”可能是______________ (填标号)。
a.Na2SO3溶液 b.双氧水 c.硝酸钠溶液 d.H2SO4酸化的KMnO4溶液
②若Ⅹ为次氯酸钠,写出气体a与X溶液反应的离子方程式____________________________。
③该方案中,操作I包含的操作名称依次为______________。
(3)①方案三设计的下列滴定方式中,最合理的是______________ (填标号)。该方案是否需要指示剂? ______________ (填“是”或“否”),原因是__________________________________________。
②滴定记录数据如下表:
滴定前读数/mL | 滴定后读数/mL | |
第一次 | 0.10 | 16.12 |
第二次 | 1.10 | 17.08 |
第三次 | 1.45 | 21.45 |
第四次 | 0.00 | 16.00 |
计算该废水试样中HSO3ˉ的浓度为______________ mol ·L-l。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列浓度关系正确的是
A.0.1 mol/L的NH4HSO4溶液中滴加0.1 mol/L的Ba(OH)2溶液至沉淀刚好完全:c (NH4+)>c (OH-)>c (SO42-)>c (H+)
B.0.1 mol/L的KOH溶液中通入标准状况下的CO2气体3.36 L,所得溶液中:c (K+)+c (H+)=c (CO32-)+c (HCO3-)+c (OH-)
C.0.1 mol/L的NaOH溶液与0.2 mol/L的HCN溶液等体积混合,所得溶液呈碱性:c (HCN)>c (Na+)>c (CN-)>c (OH-)>c (H+)
D.pH相同的NaOH溶液、CH3COONa溶液、Na2CO3溶液、NaHCO3溶液的浓度:c (NaOH)<c (CH3COONa)<c (NaHCO3)<c (Na2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铁和石墨作电极电解酸性废水,可将废水中的PO43-以FePO4(不溶于水)的形式除去,其装置如图所示。下列说法正确的是( )
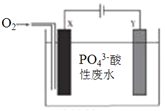
A. 若X、Y电极材料连接反了,则仍可将废水中的PO43-除去
B. X极为石墨,该电极上发生氧化反应
C. 电解过程中Y极周围溶液的pH减小
D. 电解时废水中会发生反应:4Fe2++O2+4H++4PO43- =4FePO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答以下问题:
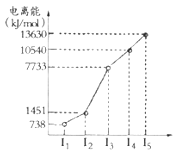
(1)第四周期的某主族元素,其第一至五电离能数据如图所示,则该元素对应原子的M层电子排布式为____________。
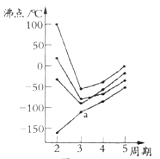
(2)如图所示,每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化.每个小黑点代表一种氢化物,其中a点代表的是______。
(3)CO2在高温高压下所形成的晶体其晶胞如图所示.该晶体的熔点比SiO2晶体________(填“高”或“低”),该晶体中碳原子轨道的杂化类型为______。
(4)化合物(CH3)3N与盐酸反应生成[(CH3)3NH]+,该过程新生成的化学键为____(填序号)。
A.离子键 B.配位键 C.氢键 D.非极性共价键
若化合物(CH3)3N能溶于水,试解释其原因:_________________________。
(5)一种新型储氢化合物A是乙烷的等电子体,其相对分子质量为30.8,且A是由第二周期两种氢化物形成的化合物。加热A会慢慢释放氢气,同时A转化为化合物B,B是乙烯的等电子体。化合物A的结构式为__________________(若含有配位键,要求用箭头表示)
(6)PCl5是一种白色晶体,在恒容密闭容器中加热可在148 ℃液化,形成一种能导电的熔体,测得其中含有一种正四面体形阳离子和一种正八面体形阴离子,熔体中P-Cl的键长只有198 nm和206 nm两种,这两种离子的化学式为______________________;正四面体形阳离子中键角小于PCl3的键角原因为_____________________________;若PBr5气态分子的结构与PCl5相似,它的熔体也能导电,经测定知其中只存在一种P-Br键长,试用电离方程式解释PBr5熔体能导电的原因______________________。
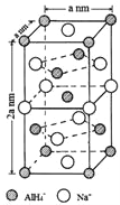
(7)氢化铝钠(NaAlH4)是一种新型轻质材料, NaAlH4可由AlCl3和NaH在适当条件下合成。NaAlH4的晶胞结构如下图所示。NaAlH4晶体中,与Na+紧邻且等距的AlH4- 有_________个;NaAlH4晶体的密度为___________g·cm-3(用含a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物排放是形成臭氧层空洞、酸雨、雾霾的重要成因之一
I.NO和CO气体均为汽车尾气的成分,目前降低尾气的可行方法是在汽车排气管上安装催化转化器,这两种气体在催化转换器中发生反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H
N2(g)+2CO2(g) △H
已知反应中相关键能数据如下:
化学键 | C | N | N | C=O |
键能/kJ·mol-1 | 1076 | 632 | 946 | 750 |
(1)由此计算△H=__________。
(2)在一定温度下,将2.0molNO、2.4molCO通入到容积固定为2L的密闭容器中,反应过程中部分物质的浓度变化如图所示:
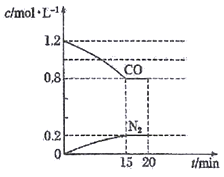
①有害气体NO的转化率为__________。
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是__________ (填序号)。
a.缩小容器体积 b.催化剂 c.降低温度 d.再通入2.0molNO
③若保持反应体系的温度不变,20min时再向容器中充入NO、N2各0.4mol,平衡将__________ (填“正向”或“逆向”)移动。
Ⅱ.SCR(选择性催化还原)脱硝法是工业上消除氮氧化物的常用方法,反应原理为:4NO(g)+4NH3(g)+O2(g)![]() 4N2(g)+6H2O(g)△H<0
4N2(g)+6H2O(g)△H<0
(3)该法可能发生副反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),减少副反应的主要措施是___________(写一条即可)。
4NO(g)+6H2O(g),减少副反应的主要措施是___________(写一条即可)。
(4)其他条件相同,在甲、乙两种催化剂作用下,NO转化率与温度的关系如图。
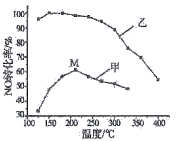
①工业上选择催化剂__________(填“甲”或“乙”),原因是____________。
②在催化剂甲作用下,图中M点处(对应温度为210℃)NO的转化率______(填“可能是”、“一定是”或“一定不是”)该温度下的平衡转化率。高于210℃时,NO转化率降低的原因可能是__________。(写一条即可)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com