
【题目】因新型冠状病毒肺炎疫情防控需求,口罩已经成为了2020每个人必备之品。熔喷布,俗称口罩的“心脏”,是口罩中间的过滤层,能过滤细菌,阻止病菌传播。熔喷布是一种以高熔融指数的聚丙烯(PP)为材料,由许多纵横交错的纤维以随机方向层叠而成的膜。其中有关聚丙烯的认识正确的是
A.由丙烯通过加聚反应合成聚丙烯
B.聚丙烯的链节:—CH2—CH2—CH2—
C.合成聚丙烯单体丙烯的结构简式:CH2CHCH3
D.聚丙烯能使溴水发生加成反应而褪色
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下表是一些键能数据![]() :
:

回答下列问题。
(1)由表中数据能否得出下列结论:
①半径越小的原子形成的共价键越牢固(即键能越大),__________(填“能”或“不能”);
②非金属性越强的原子形成的共价键越牢固,__________(填“能”或“不能”)。能否从数据中找出一些规律,请写出一条:______________________________。试预测C-Br键的键能范围:__________<C-Br键能<__________。
(2)由热化学方程式![]()
![]() 并结合上表数据可推知一个化学反应的反应热(设反应物和生成物均为气态)与反应物和生成物的键能之间的关系是_____________;
并结合上表数据可推知一个化学反应的反应热(设反应物和生成物均为气态)与反应物和生成物的键能之间的关系是_____________;
(3)由热化学方程式![]()
![]() 和表中数值可计算出
和表中数值可计算出![]() 变为
变为![]() 时将__________(填“吸收”或“放出”)__________kJ的热量。
时将__________(填“吸收”或“放出”)__________kJ的热量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F是合成一种天然茋类化合物的重要中间体,其合成路线如下:

(1)A中含氧官能团的名称为________和________。
(2)A→B的反应类型为________。
(3)C→D的反应中有副产物X(分子式为C12H15O6Br)生成,写出X的结构简式:________。
(4)C的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:________。
①能与FeCl3溶液发生显色反应;
②碱性水解后酸化,含苯环的产物分子中不同化学环境的氢原子数目比为1∶1。
(5)已知: (R表示烃基,R'和R"表示烃基或氢),写出以
(R表示烃基,R'和R"表示烃基或氢),写出以 和CH3CH2CH2OH为原料制备
和CH3CH2CH2OH为原料制备 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。________________________
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D 为原子序数依次增大的短周期主族元素,E 是一种过渡元素。A 基态原子 L 层中 p 轨道电子数是 s 轨道电子数的 2 倍,B 是同周期元素中最活泼的金属元素, C 和 A 形成的一种化合物是引起酸雨的主要大气污染物之一,E 的基态原子 4s 轨道半充满 和 3d 轨道全充满。请回答下列问题:
(1)B 基态原子的电子排布式是___________,C 和 D 中电负性较大的是______填元素符号)。
(2)C 的氢化物的沸点低于与其组成相似的 A 的氢化物,其原因是___________。
(3)C 与 A 形成的 CA3 分子的空间构型是___________。
(4)A 和 B 所形成的一种离子化合物 B2A 晶体的晶胞如图所示,则图中黑球代表的离子是_____(填离子符号)。

(5)在过量的氨水中,E 的阳离子与氨分子通过___________形成一种显深蓝色的离子, 该离子的符号为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验方案及所选玻璃容器(非玻璃容器任选)就能实现相应实验目的的是
实验目的 | 实验方案 | 所选玻璃仪器 | |
A | 除去KNO3中少量NaCl | 将混合物制成热的饱和溶液,冷却结晶,过滤 | 酒精灯、烧杯、玻璃棒 |
B | 证明CH3COOH与HClO的酸性强弱 | 相同温度下用pH试纸测定浓度均为0.1 mol·L-1NaClO、CH3COONa溶液的pH | 玻璃棒、玻璃片 |
C | 配制1 L 1.6%的CuSO4溶液(溶液密度近似为1 g·mL-1) | 将25 g CuSO4·5H2O溶解在975 g水中 | 烧杯、量筒、玻璃棒 |
D | 检验蔗糖水解产物具有还原性 | 向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,再向其中加入新制的银氨溶液,并水浴加热 | 试管、烧杯、酒精灯、滴管 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是常用的氧化剂。工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体。中间产物为锰酸钾。下图是实验室模拟制备KMnO4晶体的操作流程:

已知:锰酸钾(K2MnO4)是墨绿色晶体,其水溶液呈深绿色,这是锰酸根离子(MnO42-)在水溶液中的特征颜色,在强碱性溶液中能稳定存在;在酸性、中性和弱碱性环境下,MnO42-会发生自身氧化还原反应,生成MnO4-和MnO2。
回答下列问题:
(1)KOH的电子式为______,煅烧KOH和软锰矿的混合物应放在_______中加热(填标号)。
a.烧杯 b.瓷坩埚 c.蒸发皿 d.铁坩埚
(2)调节溶液pH过程中,所得氧化产物与还原产物的物质的量之比为______。
(3)趁热过滤的目的是_______________________________。
(4)已知20℃时K2SO4、KCl、CH3COOK的溶解度分别为11.1g、34g、217g,则从理论上分析,选用下列酸中__________(填标号),得到的高锰酸钾晶体纯度更高。
a.稀硫酸 b.浓盐酸 c.醋酸 d.稀盐酸
(5)产品中KMnO4的定量分析:
①配制浓度为0.1250mg·mL-1的KMnO4标准溶液100mL。
②将上述溶液稀释为浓度分别为2.5、5.0、7.5、10.0、12.5、15.0(单位:mg·L-1)的溶液,分别测定不同浓度溶液对光的吸收程度,并将测定结果绘制成曲线如下。

③称取KMnO4样品(不含K2MnO4)0.1250g按步骤①配得产品溶液1000mL,取10mL稀释至100mL,然后按步骤②的方法进行测定,两次测定所得的吸光度分别为0.149、0.151,则样品中KMnO4的质量分数为____。
(6)酸性KMnO4溶液与FeSO4溶液反应的离子方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或有关化学用语的表达正确的是( )
A.在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量
B.基态Fe原子的价电子轨道表示式为
C.因硫元素电负性比磷元素大,故硫元素第一电离能比磷元素第一电离能大
D.根据原子核外电子排布的特点,Cu在元素周期表中位于s区
查看答案和解析>>
科目:高中化学 来源: 题型:
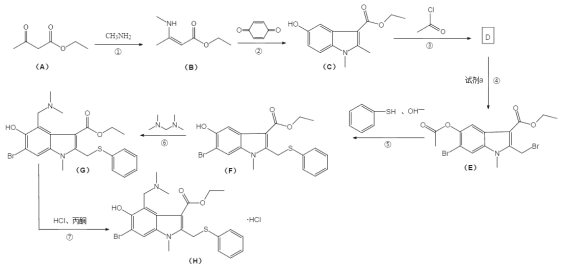
【题目】盐酸阿比朵尔,适合治疗由 A、B 型流感病毒引起的上呼吸道感染,2020 年入选新冠肺炎试用药物,其合成路线:
回答下列问题:
(1)有机物 A 中的官能团名称是______________和______________。
(2)反应③的化学方程式______________。
(3)反应④所需的试剂是______________。
(4)反应⑤和⑥的反应类型分别是______________、______________。
(5)I 是 B 的同分异构体,具有两性并能与碳酸氢钠溶液反应放出气体,写出具有六元 环结构的有机物 H 的结构简式______________。 (不考虑立体异构,只需写出 3 个)
(6)已知:两分子酯在碱的作用下失去一分子醇生成β—羟基酯的反应称为酯缩合反应,也称为 Claisen (克莱森)缩合反应,如: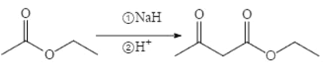 ,设计由乙醇和
,设计由乙醇和![]() 制备
制备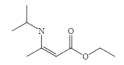 的合成线路______________。(无机试剂任选)
的合成线路______________。(无机试剂任选)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com