
【题目】填写下列空白:
(1) ______mol H2O中含有的氧原子数与1.5 mol CO2中含有的氧原子数相等。
(2)将等物质的量的NH3和CH4混合,混合气体中NH3与CH4的质量比为______。
(3)要使NH3与CH4含相同数目的H原子,则NH3和CH4的物质的量之比为______。
(4)标准状况下,密度为0.75 g·L1的NH3与CH4组成的混合气体中,NH3的体积分数为______,该混合气体对氢气的相对密度为______。
(5)某结晶水合物的化学式为A·nH2O,A的相对分子质量为M。如将a g该结晶水合物加热至结晶水全部失去,剩余的残渣为b g,则n=______。
(6)已知a g A和b g B恰好完全反应生成0.2 mol C和d g D,则C的摩尔质量为______。
【答案】(1)3(1分)
(2)17∶16(1分)
(3)4∶3
(4)80% 8.4
(5)![]()
(6)5(a+bd) g·mol1
【解析】(4)![]() =0.75 g·L1×22.4 L·mol1=16.8 g·mol1。设NH3的物质的量为x,CH4的物质的量为y,则
=0.75 g·L1×22.4 L·mol1=16.8 g·mol1。设NH3的物质的量为x,CH4的物质的量为y,则![]() =16.8 g·mol1,x∶y=4∶1,NH3的体积分数为
=16.8 g·mol1,x∶y=4∶1,NH3的体积分数为![]() ×100%=80%,该混合气体对H2的相对密度为
×100%=80%,该混合气体对H2的相对密度为![]() =8.4。
=8.4。
(5)A·nH2O![]() A+nH2O
A+nH2O
M+18n M
a g b g
(M+18n)∶M=a∶b
解得n=![]() 。
。
(6)依据质量守恒定律有a g+b g=0.2 mol·M(C)+d g,解得M(C)=5(a+bd) g·mol1。


科目:高中化学 来源: 题型:
【题目】已知甲、乙、丙三种金属只有乙能与酸溶液反应产生氢气,而将金属丙投入到金属甲的盐溶液中,能观察到金属丙的表面有金属甲析出。则下列关于金属甲、乙、丙的金属活动性顺序排列正确的是( )
A. 乙>丙>甲B. 甲>丙>乙
C. 乙>甲>丙D. 甲>乙>丙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加快的是( )
A. 加热升高温度 B. 改用98%浓硫酸
C. 滴加少量硫酸铜溶液 D. 不用铁片,改用铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A1.44g完全燃烧生成2.16g H2O,生成的CO2恰好与200mL 1mol/LKOH溶液作用生成正盐,将A试样进行检测所得质谱图如下图。

(1)请写出A的最简式_____________。
(2)请写出A的分子式______________。
(3)若A的一氯代物只有一种,写出A的结构简式并用系统命名法,A的结构简式为_____________系统命名_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:

苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按以下合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑。在b中小心加入4.0mL液态溴.向a中滴入几滴溴,有白雾产生,是因为生成了_________气体,继续滴加至液溴滴完。装置d的作用是_________;
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是_________;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是_________;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为_________,要进一步提纯,下列操作中必须的是____________(填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是_____________(填入正确选项前的字母):
A.25mL B.50mL C.250mL D.500mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴(Co)是重要的稀有金属,在工业和科技领域具有广泛的用途。从某含钴工业废料中回收钴的工艺流程如下:
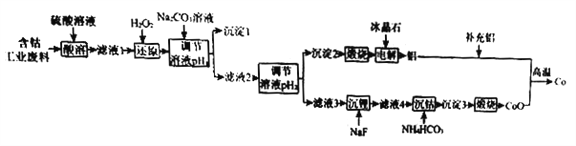
已知:
含钴废料的成分 | |||||
成分 | Al | Li | Co2O3 | Fe2O3 | 其他不溶于强酸的杂质 |
质量分数/% | 10.5 | 0.35 | 65.6 | 9.6 | 13.95 |
Ⅱ.实验中部分离子开始沉淀和沉淀完全的pH | |||
金属离子 | Fe3+ | Co2+ | Al3+ |
开始沉淀的pH | 1.9 | 7.15 | 3.4 |
沉淀完全的pH | 3.2 | 9.15 | 4.7 |
Ⅲ.离子浓度小于等于1.0×10-5 mol·L-1时,认为该离子沉淀完全。
请回答下列问题:
(1)NaF的电子式为____________。
(2)“沉淀1”的化学式为____________________。“调节溶液pH2”的范围为_________________。
(3)“还原”时发生反应的离子方程式为_______________________。
“沉钴”时发生反应的离子方程式为________________________。
(4)制备Co时,“补充铝”的原因为_________________________。
(5)已知:l0-0.9≈0.13,则 A1(OH)3 的溶度积常数 Ksp=_____________________。
(6)Li-SOCl2电池可用于心脏起搏器,该电池的总反应可表示为::4Li+2SOCl2=4LiCl+S+SO2,其正极反应式为_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能够成功的是
A. 只用溴水一种试剂可鉴别甲苯、乙烯、乙醇、四氯化碳四种物质
B. 将乙醇加热到170 ℃可制得乙烯
C. 用乙醇、冰醋酸及pH=0的硫酸加热可制乙酸乙酯
D. 苯与溴水在FeBr3的催化下制取溴苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. C6H5OH与C6H5CH2OH互为同系物
B. 乙醇和乙醚互为同分异构体
C. 乙醇、乙二醇、丙三醇互为同系物
D. 可用浓溴水来区分乙醇和苯酚
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com