
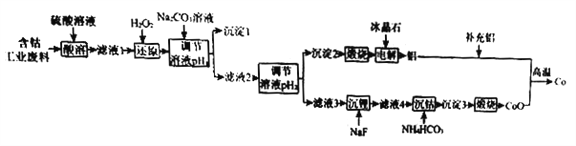
【题目】钴(Co)是重要的稀有金属,在工业和科技领域具有广泛的用途。从某含钴工业废料中回收钴的工艺流程如下:
已知:
含钴废料的成分 | |||||
成分 | Al | Li | Co2O3 | Fe2O3 | 其他不溶于强酸的杂质 |
质量分数/% | 10.5 | 0.35 | 65.6 | 9.6 | 13.95 |
Ⅱ.实验中部分离子开始沉淀和沉淀完全的pH | |||
金属离子 | Fe3+ | Co2+ | Al3+ |
开始沉淀的pH | 1.9 | 7.15 | 3.4 |
沉淀完全的pH | 3.2 | 9.15 | 4.7 |
Ⅲ.离子浓度小于等于1.0×10-5 mol·L-1时,认为该离子沉淀完全。
请回答下列问题:
(1)NaF的电子式为____________。
(2)“沉淀1”的化学式为____________________。“调节溶液pH2”的范围为_________________。
(3)“还原”时发生反应的离子方程式为_______________________。
“沉钴”时发生反应的离子方程式为________________________。
(4)制备Co时,“补充铝”的原因为_________________________。
(5)已知:l0-0.9≈0.13,则 A1(OH)3 的溶度积常数 Ksp=_____________________。
(6)Li-SOCl2电池可用于心脏起搏器,该电池的总反应可表示为::4Li+2SOCl2=4LiCl+S+SO2,其正极反应式为_____________
【答案】 ![]() Fe(OH)3 4.7≤pH≤7.15 2CO3-+H2O2=2CO2-+O2↑2H+ CO2-+2HCO3-=COCO3↓+CO2↑+H2O 原混合物中Al和Co的物质的量之比小于2:3 1.3
Fe(OH)3 4.7≤pH≤7.15 2CO3-+H2O2=2CO2-+O2↑2H+ CO2-+2HCO3-=COCO3↓+CO2↑+H2O 原混合物中Al和Co的物质的量之比小于2:3 1.3 ![]() 10-33 2SOCl2+4e-=S+SO2+4Cl-
10-33 2SOCl2+4e-=S+SO2+4Cl-
【解析】(1)NaF属于离子化合物,电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)含钴工业废料用硫酸溶解后,废料中的铝、锂、氧化钴、氧化铁等被硫酸溶解,滤去残渣后有双氧水将Co3+还原为Co2+,根据部分离子开始沉淀和沉淀完全的pH,再用碳酸钠溶液调节溶液的pH,使铁离子沉淀除去,滤液2,再调节溶液的pH使铝离子沉淀,提供电解冶炼铝的原料。 “调节溶液pH2”的范围为4.7≤pH≤7.15,故答案为:Fe(OH)3;4.7≤pH≤7.15;
(3)“还原”时双氧水被Co3+氧化,反应的离子方程式为2Co3++H2O2=2Co2++O2↑+2H+,“沉钴”时碳酸氢铵与Co2+反应生成碳酸钴沉淀,反应的离子方程式为Co2++2HCO3-=CoCO3↓+CO2↑+H2O,故答案为:2Co3++H2O2=2Co2++O2↑+2H+;Co2++2HCO3-=CoCO3↓+CO2↑+H2O
(4)制备Co时的反应方程式为3CoO+2Al![]() 3Co+ Al2O3,当原混合物中Al和Co的物质的量之比小于2:3时,需要 补充铝,便于反应完全进行,故答案为:原混合物中Al和Co的物质的量之比小于2:3;
3Co+ Al2O3,当原混合物中Al和Co的物质的量之比小于2:3时,需要 补充铝,便于反应完全进行,故答案为:原混合物中Al和Co的物质的量之比小于2:3;
(5)Al3+完全沉淀时的pH=4.7,则 A1(OH)3 的溶度积常数 Ksp=1.0×10-5×(![]() )3=1.0×10-32.9=1.3
)3=1.0×10-32.9=1.3 ![]() 10-33,故答案为:1.3
10-33,故答案为:1.3 ![]() 10-33;
10-33;
(6)根据总反应4Li+2SOCl2=4LiCl+S+SO2,正极发生还原反应,SOCl2被还原生成S+SO2以及氯离子,反应式为2SOCl2+4e-=S+SO2+4Cl-,故答案为:2SOCl2+4e-=S+SO2+4Cl-。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 已知二元酸H2A在溶液中的电离方程式为:H2A=H++HA- HA-![]() H++A2-,则NaHA溶液中离子浓度的关系有:c(Na+)=c(A2-)+c(HA-)+c(H2A)和c(A2-)=c(H+)- c(OH-)
H++A2-,则NaHA溶液中离子浓度的关系有:c(Na+)=c(A2-)+c(HA-)+c(H2A)和c(A2-)=c(H+)- c(OH-)
B. 已知:室温时Ka(HA)=10-5.则室温时 0.1mol/LNaA溶液的pH约为10
C. HCN溶液加水稀释的过程中c(H+)/c(CN-)减小
D. 向明矾溶液中逐滴滴入Ba(OH)2溶液至硫酸根离子刚好完全沉淀时,所得溶液中离子浓度关系有:c(K+)>c(AlO2-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 按系统命名法,有机物![]() 的名称是2,2,4,5-四甲基-3,3-二乙基己烷
的名称是2,2,4,5-四甲基-3,3-二乙基己烷
B. 苯、甲苯、二甲苯互为同系物,均能使酸性高锰酸钾溶液褪色
C. 等质量的苯、乙炔、乙烯和甲烷分别在氧气中充分燃烧,所消耗的氧气的量依次增加
D. 分子式为C4H8O2的同分异构体中,属于酸类和酯类的共有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填写下列空白:
(1) ______mol H2O中含有的氧原子数与1.5 mol CO2中含有的氧原子数相等。
(2)将等物质的量的NH3和CH4混合,混合气体中NH3与CH4的质量比为______。
(3)要使NH3与CH4含相同数目的H原子,则NH3和CH4的物质的量之比为______。
(4)标准状况下,密度为0.75 g·L1的NH3与CH4组成的混合气体中,NH3的体积分数为______,该混合气体对氢气的相对密度为______。
(5)某结晶水合物的化学式为A·nH2O,A的相对分子质量为M。如将a g该结晶水合物加热至结晶水全部失去,剩余的残渣为b g,则n=______。
(6)已知a g A和b g B恰好完全反应生成0.2 mol C和d g D,则C的摩尔质量为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关胶体的叙述不正确的是( )
A. 胶体微粒同其他微观粒子一样,在不停地运动着
B. 一束平行光线照射蛋白质溶液时,从侧面可以看到一条光亮的通路
C. 给Fe(OH)3胶体通电后发现一端电极附近颜色变深
D. 胶体微粒能吸附阳离子或阴离子,从而使胶体带有一定电荷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)阅读、分析下列两个材料:
材料一

材料二
物质 | 熔点/℃ | 沸点/℃ | 密度/(g·cm3) | 溶解性 |
乙二醇(C2H6O2) | 11.5 | 198 | 1.11 | 易溶于水和乙醇 |
丙三醇(C3H8O3) | 17.9 | 290 | 1.26 | 能跟水、乙醇以任意比互溶 |
请选择正确的分离方法(填字母):
①将纯碱从氯化钠和纯碱的混合物中分离出来,最好应用________。
②将乙二醇和丙三醇相互分离的最佳方法是_________。
A.蒸馏法 B.萃取法 C.“溶解、结晶、过滤”的方法 D.分液法
(2)阅读材料三:
在溶解性方面,Br2(溴)与I2很相似,其稀的水溶液显黄色。在实验室里从溴水(Br2的水溶液)中提取Br2和提取I2的方法相似。
①常用的提取方法是________________,化学试剂是________,最主要的仪器是__________。
②若观察发现提取Br2以后的水还有颜色,解决该问题的方法是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示的装置及NaOH溶液、铁屑、稀H2SO4等试剂可以制得白色的Fe(OH)2沉淀。

(1)在试管Ⅰ里加入的试剂是____________________。
(2)在试管Ⅱ里加入的试剂是____________。
(3)为了制得白色Fe(OH)2沉淀,正确的操作顺序是______ (填下列序号)
①打开止水夹 ②检验试管Ⅱ出口处排出的H2的纯度 ③夹紧止水夹 ④在试管Ⅰ和Ⅱ中加入试剂,塞紧塞子
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是:_________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于二氧化碳和二氧化硅的说法中正确的是( )
A. 二氧化碳和二氧化硅分别是碳酸和硅酸的酸酐
B. 二氧化碳和二氧化硅与水反应分别生成相应的酸
C. 二氧化碳是酸性氧化物,二氧化硅是两性氧化物
D. 二氧化碳和二氧化硅都是由相应的分子组成的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硫酸厂用以下几种方法处理SO2尾气。
(1)亚硫酸钠吸收法
① Na2SO3溶液吸收SO2的离子方程式为_______________;其产物的溶液中离子浓度由大到小的排列顺序为______________。
② 常温下,当吸收至pH=6时,吸收液中相关离子浓度关系一定正确的是_______
(填序号)
a.c(Na+)+c(H+)>c(SO32-)+c(HSO3-)+c(OH-)
b.c(Na+)=c(SO32-)+c(HSO3-)+C(H2SO3)
c.c(Na+)>c(SO32-)>c(OH一)>c(H+)
d.水电离出c(OH一)=1×l0-8mol/L
③25 ℃时,H2SO3![]() HSO
HSO![]() +H+的电离常数Ka=1×10-2mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kh=______mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中
+H+的电离常数Ka=1×10-2mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kh=______mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中![]() 将________(填“增大”、“减小”或“不变”)。
将________(填“增大”、“减小”或“不变”)。
(2)电化学处理法

如图所示,Pt(1)电极的反应式为_________;碱性条件下,用Pt(2)电极排出的S2O42-溶液吸收NO2,使其转化为N2,同时有SO32-生成。若阳极转移电子6mol,则理论上处理NO2气体____mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com