
【题目】某硫酸厂用以下几种方法处理SO2尾气。
(1)亚硫酸钠吸收法
① Na2SO3溶液吸收SO2的离子方程式为_______________;其产物的溶液中离子浓度由大到小的排列顺序为______________。
② 常温下,当吸收至pH=6时,吸收液中相关离子浓度关系一定正确的是_______
(填序号)
a.c(Na+)+c(H+)>c(SO32-)+c(HSO3-)+c(OH-)
b.c(Na+)=c(SO32-)+c(HSO3-)+C(H2SO3)
c.c(Na+)>c(SO32-)>c(OH一)>c(H+)
d.水电离出c(OH一)=1×l0-8mol/L
③25 ℃时,H2SO3![]() HSO
HSO![]() +H+的电离常数Ka=1×10-2mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kh=______mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中
+H+的电离常数Ka=1×10-2mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kh=______mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中![]() 将________(填“增大”、“减小”或“不变”)。
将________(填“增大”、“减小”或“不变”)。
(2)电化学处理法

如图所示,Pt(1)电极的反应式为_________;碱性条件下,用Pt(2)电极排出的S2O42-溶液吸收NO2,使其转化为N2,同时有SO32-生成。若阳极转移电子6mol,则理论上处理NO2气体____mol。
【答案】 SO32-+SO2+ H2O=2HSO3- (Na+) > c(HSO3-)> c(H+)> c(SO32-) >c(OH-) ad 1×10-12 增大 SO2-2e-+2 H2O=SO42-+ 4H+ 1.5
【解析】(1)本题考查SO2的性质和离子浓度大小顺序、电离平衡常数的计算,①SO2与CO2在某些性质上具有相似,因此SO2与Na2SO3反应的离子方程式为SO2+SO32-+H2O=2HSO3-,HSO3-的电离程度大于其水解程度,溶液显酸性,HSO3-部分电离,即离子浓度大小顺序是 (Na+) > c(HSO3-)> c(H+)> c(SO32-) >c(OH-);②a、根据电荷守恒,c(Na+)+c(H+)=c(OH-)+c(HSO3-)+2c(SO32-),因此有c(Na+)+c(H+)>c(OH-)+c(HSO3-)+c(SO32-),故a正确;b、如果溶质只有NaHSO3,根据物料守恒, c(Na+) = c(SO32-)+ c(HSO3-)+ C(H2SO3),如果溶质为NaHSO3和H2SO3,则 c(Na+)< c(SO32-)+ c(HSO3-)+ C(H2SO3),故b错误;c、pH=6,溶液显酸性,即c(H+)>c(OH-),故c错误;d、根据水的离子积,c(OH-)=Kw/c(H+)=10-14/10-6mol·L-1=10-8mol·L-1,故d正确;③根据Kh=Kw/Ka1=1×10-14/10-2=1×10-12;加入I2,发生HSO3-+I2+H2O=SO42-+2I-+3H+,然后发生H++HSO3-=H2SO3,因此c(H2SO3)增大,c(HSO3-)减小,此比值增大;(2)考查电极反应式的书写和电化学计算,根据装置图,Pt(1)电极SO2→H2SO4,S的化合价升高,失去电子,即Pt(1)作阳极,即电极反应式为SO2+2H2O-2e-=4H++SO42-;Pt(2)电极反应式为2HSO3-+2H++2e-=S2O42-+2H2O,转移电子6mol,生成S2O42-物质的量6/2mol=3mol,然后根据得失电子数目守恒,3×2×1=n(NO2)× 4,即n(N2)= 1.5mol。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】钴(Co)是重要的稀有金属,在工业和科技领域具有广泛的用途。从某含钴工业废料中回收钴的工艺流程如下:
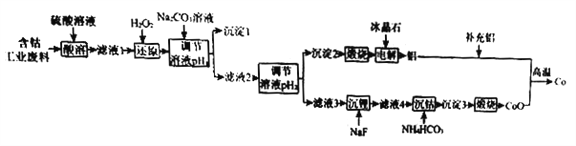
已知:
含钴废料的成分 | |||||
成分 | Al | Li | Co2O3 | Fe2O3 | 其他不溶于强酸的杂质 |
质量分数/% | 10.5 | 0.35 | 65.6 | 9.6 | 13.95 |
Ⅱ.实验中部分离子开始沉淀和沉淀完全的pH | |||
金属离子 | Fe3+ | Co2+ | Al3+ |
开始沉淀的pH | 1.9 | 7.15 | 3.4 |
沉淀完全的pH | 3.2 | 9.15 | 4.7 |
Ⅲ.离子浓度小于等于1.0×10-5 mol·L-1时,认为该离子沉淀完全。
请回答下列问题:
(1)NaF的电子式为____________。
(2)“沉淀1”的化学式为____________________。“调节溶液pH2”的范围为_________________。
(3)“还原”时发生反应的离子方程式为_______________________。
“沉钴”时发生反应的离子方程式为________________________。
(4)制备Co时,“补充铝”的原因为_________________________。
(5)已知:l0-0.9≈0.13,则 A1(OH)3 的溶度积常数 Ksp=_____________________。
(6)Li-SOCl2电池可用于心脏起搏器,该电池的总反应可表示为::4Li+2SOCl2=4LiCl+S+SO2,其正极反应式为_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酯分子式为C6H12O2,该酯水解后生成A和B,B是A的同分异构体的氧化产物,该酯为 ( )
A. CH3CH(CH3)COOC2H5 B. CH3CH2COO(CH2)2CH3
C. CH3COO(CH2)3CH3 D. CH3CH2COOCH(CH3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. C6H5OH与C6H5CH2OH互为同系物
B. 乙醇和乙醚互为同分异构体
C. 乙醇、乙二醇、丙三醇互为同系物
D. 可用浓溴水来区分乙醇和苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用等体积的0.1 mol/L的BaCl2溶液,可使相同体积的Fe2(SO4)3、Na2SO4、KAl(SO4)2三种溶液的![]() 完全沉淀,则三种硫酸盐的物质的量浓度之比为
完全沉淀,则三种硫酸盐的物质的量浓度之比为
A.3∶2∶3 B.3∶1∶2 C.2∶6∶3 D.1∶1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】查尔酮是一种重要的化工原料,可以通过如下过程合成。请回答下列有关问题:

(1)已知A的分子式为C8H10,它的结构简式为_______。查尔酮的结构属于烯烃的_____ (填“顺式”或“反式”)异构。
(2) B转化成C的反应类刑属于________;C分子中含氧官能团为______。
(3)D物质在OH-存在时与苯甲醛反应的化学方程式为___________。
(4) D的同分异构体中,属于芳香醛的有_____种;其中核磁共振氢谱吸收峰种类最少的一种同分异构体的名称为________。
(5)参照上述合成路线,写出由CH3CH=CH2制取丙酮的流程图:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在恒容密闭容器中发生反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)。下列能说明反应达到平衡状态的是
SO3(g)+NO(g)。下列能说明反应达到平衡状态的是
A. 体系的压强保持不变
B. 混合气体的密度保持不变
C. 混合气体的颜色保持不变
D. 每消耗1molSO3的同时生成1molNO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—定温度下,下列溶液的离子浓度关系式正确的是( )
A. pH=5 的H2S溶液中,c(H+)>c(HS-)=1×10-5mol/L
B. 将等物质的量的Na2CO3和NaHCO3混合溶于水中:![]()
C. pH之和为14的H2C2O4与NaOH 溶液混合:c(Na+)>c(H+)>c(OH-)>c(HC2O4-)
D. 0.1 mol / L 的硫酸铵溶液中:c(SO42-)>c(NH4+)> c(H+)> c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素单质及其化合物有广泛用途,请回答下列问题:
(1)第三周期元素中,钠原子核外有_______种能量不同的电子;氯原子的最外层电子排布式为______________;由这两种元素组成的化合物的电子式为__________。
(2)下列气体能用浓硫酸干燥的是________。
A.NH3 B.HI C.SO2 D.CO2
(3)请用一个实验事实说明钠与镁的金属性强弱________________________________。
(4)KClO3可用于实验室制O2,若不加催化剂,400 ℃时可分解生成两种盐,化学方程式为:KClO3 ![]() KCl+KClO4 (未配平),则氧化产物与还原产物的物质的量之比为_________。
KCl+KClO4 (未配平),则氧化产物与还原产物的物质的量之比为_________。
(5)已知:
化合物 | MgO | MgCl2 |
类型 | 离子化合物 | 离子化合物 |
熔点/℃ | 2800 | 714 |
工业上电解MgCl2制单质镁,而不电解MgO的原因是________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com