
【题目】已知:SO32-+I2+H2O= SO42-+2I-+2H+。某无色溶液中可能含有I-、NH4+、Cu2+、SO32-,向该溶液中加入少量溴水,溶液仍呈无色,下列关于溶液组成的判断正确的是
①肯定不含I- ②肯定不含Cu2+ ③肯定含有SO32 - ④可能含有I-
A. ①③ B. ①②③ C. ①② D. ②③④
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:
【题目】t℃时,某平衡体系中含有X、Y、Z、W四种物质,此温度下发生反应的平衡常数表达式为: ![]() 。有关该平衡体系的说法正确的是
。有关该平衡体系的说法正确的是
A.升高温度.平衡常数K一定增大
B.增大压强.W(g)质量分数增加
C.升高温度.若混合气体的平均相对分子质量变小.则正反应是放热反应
D.增大X(g)浓度.平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在未知液中加入AgNO3溶液有白色沉淀生成,加入稀硝酸后,沉淀部分溶解,有无色无味的气体牛成,将气体通人澄清石灰水,石灰水变浑浊,由此判断水溶液中含有( )
A.Cl-,S042-
B.Cl-,NO3-
C.Cl-,CO32-
D.Cl-,OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,已知⑤为短周期元素,其单质为淡黄色固体,据表回答有关问题:
① | ② | ||||||
③ | ④ | ⑤ | ⑥ | ⑦ | |||
⑧ | ⑨ |
(1)画出元素⑧的原子结构示意图 __________________
(2)在这些元素中,最活泼的非金属元素是 ______, 最不活泼的元素是_____(写元素符号 )。
(3)在这些元素的最高价氧化物对应水化物中, 碱性最强的是 __________(写化学式),呈两性的氢氧化物是____________(写化学式),写出两者之间反应的离子方程式: ______________________________
(4)在⑥与⑨中,化学性质较活泼的是________(写元素符号 ),写出可以验证该结论的一个化学反应方式 _________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G七种短周期元素,原子序数依次增大。由A、B形成的单质在一定条件下可生成气体X且X的水溶液呈碱性;D原子K层电子数是其M层电子数的2倍;E的简单阳离子与X具有相同电子数,且E的简单阳离子是同周期中简单离子半径最小的元素;F元素的原子最外层比次外层少两个电子,C和G的最外层电子数之和为13 。则
(1)C在周期表中的位置为 _________________ ;
(2)写出:D在C单质中燃烧所生成淡黄色的固体的电子式_______________
(3)A、B、D、E四种元素的原子,半径由大到小的顺序为________________。(用元素符号表示 )
(4)G的单质在反应中常作氧化剂,该单质的水溶液与F的低价氧化物反应的化学方程式为______________________。
(5)写出由A、C、D、F这四种元素共同组成的2种化合物在水溶液中发生反应的离子方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差l;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强。下列说法不正确的是
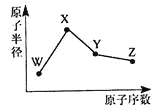
A. 对应简单离子半径:W>X
B. 对应气态氢化物的稳定性:Y<Z
C. 化合物XZW既含离子键,又含共价键
D. Z的氢化物和X的最高价氧化物对应水化物的溶液均能与Y的氧化物反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硅元素的叙述中,正确的是( )
A.SiO2不溶于水,也不溶于任何酸
B.SiO2是良好的半导体材料
C.硅是地壳中含量最多的元素
D.水玻璃可用作木材防火剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某种氨基酸(CxHyOzNp)的分子组成。取n g该种氨基酸放在纯氧气中充分燃烧,生成CO2、H2O和N2。现按图所示装置进行实验:

请回答下列有关问题:
(1)实验开始时,首先要通入一段时间的氧气,其理由是____________________;
(2)以上装置中需要加热的仪器有________(用字母填空)。操作时应先点燃________处的酒精灯;
(3)装置D的作用是___________________________________;
(4)读取N2体积时,应注意:①_____________________;②__________________。
(5)实验中测得N2的体积为V mL(已折算为标准状况)。为确定此氨基酸的分子式,还需要的有关数据有________(用字母填空)。
A.生成CO2气体的质量 B.生成H2O的质量
C.通入O2的体积 D.氨基酸的相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
(A)移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞;
(B)用标准溶液润洗滴定管2-3次;
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm;
(E)调节液面至0或0刻度以下,记下读数;
(F)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度;
完成以下填空:
(1)正确操作的顺序是:(用序号字母填写)B、D、_______________.
(2)上述(B)操作的目的是_____________________。
(3)上述(A)操作之前,如先用待测液润洗锥形瓶,则对测定结果的影响是(填偏大、偏小、不变,下同)_________________。
(4)实验中用左手控制 (填仪器及部位),眼睛注视 ,直至滴定终点。判断到达终点的现象是 。
(5)若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸,则对测定结果的影响是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com