
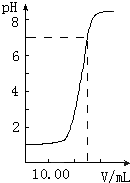
 如图是向20.00mL盐酸中逐渐滴入NaOH溶液时,溶液pH值变化的图象,根据图象分析,下列结论中不正确的是( )
如图是向20.00mL盐酸中逐渐滴入NaOH溶液时,溶液pH值变化的图象,根据图象分析,下列结论中不正确的是( )| 0.02L×0.1mol/L-0.02L×0.08mol/L |
| 0.04L |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
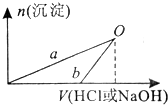 某同学研究铝及其化合物的性质设计了如下两个实验方案.
某同学研究铝及其化合物的性质设计了如下两个实验方案.| A、b曲线表示的是向x溶液中加入NaOH溶液 | B、在O点时两方案中所得溶液浓度相等 | C、a、b曲线表示的反应都是非氧化还原反应 | D、Y溶液显碱性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.盐酸起始浓度为0.1mol?L-1 |
| B.NaOH溶液浓度为0.08mol?L-1 |
| C.滴入碱量为20mL时,向混合溶液中滴入2滴甲基橙试液,溶液显橙色 |
| D.滴到中和点时,耗NaOH物质的量为0.002mol |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年吉林省长春二中高二(上)期中化学试卷(解析版) 题型:选择题
查看答案和解析>>
科目:高中化学 来源: 题型:
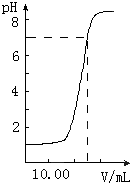
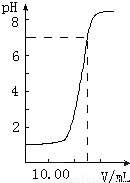
下图是向20.00mL盐酸中逐渐滴入NaOH溶液时,溶液pH值变化的图象,根据图象分析,下列结论中不正确的是
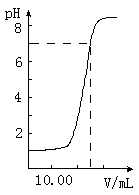
A、盐酸起始浓度为0.1mol?L-1
B、NaOH溶液浓度为0.08mol?L-1
C、滴入碱量为20mL时,向混合溶液中滴入2滴甲基橙试液,溶液显橙色
D、滴到中和点时,耗NaOH物质的量为0.002mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com