
 (g) ��H����25 KJ/mol
(g) ��H����25 KJ/mol 
 ��Ӣ���㿨ϵ�д�
��Ӣ���㿨ϵ�д� Ӧ����㲦ϵ�д�
Ӧ����㲦ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2SO3( g ) ���� H =-QkJ��mol-1�����������·ֱ���������ͷ�Ӧ�ų������� ( Q)���±����У������������ݣ�����������ȷ���ǣ� ��
2SO3( g ) ���� H =-QkJ��mol-1�����������·ֱ���������ͷ�Ӧ�ų������� ( Q)���±����У������������ݣ�����������ȷ���ǣ� ��| ���� | SO2 (mol) | O2(mol) | SO3 (mol) | Q(kJ��mol-1) |
| �� | 2 | 1 | 0 | Q1 |
| �� | 1 | 0.5 | 0 | Q2 |
| �� | 1 | 0.5 | 1 | Q3 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��Zn(s)��CuSO4(aq)===ZnSO4(aq)��Cu(s) ��H����216 kJ��mol��1��E��Ӧ��<E������ |
| B��CaCO3(s)===CaO(s)��CO2(g)����H����178.5 kJ��mol��1��E��Ӧ��<E������ |
| C��HI(g)??H2(g)��I2(s)����H����26.5 kJ��mol��1,1 mol HI���ܱ������зֽ��ƽ���ų�26.5 kJ������ |
| D��H��(aq)��OH��(aq)===H2O(l)����H����57.3 kJ��mol��1,1 L 1 mol��L��1��NaOH��Һ�뺬0.5 mol H2SO4��Ũ�����Ϻ����57.3 kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��Q1�� Q2 | B��Q1��Q2 | C��Q1��Q2 | D����ȷ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ��ʴ���

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 ����֪����1molN��N����167kJ����������1mol N��N�ų�942kJ����������������Ϣ�����ݣ�����N2��������1mol��̬N4�ġ�HΪ�� ��
����֪����1molN��N����167kJ����������1mol N��N�ų�942kJ����������������Ϣ�����ݣ�����N2��������1mol��̬N4�ġ�HΪ�� ��| A��+882kJ��mol-1 | B��+441kJ��mol-1 | C����882kJ��mol-1 | D����441kJ��mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����ϡ��Һ��������ͼӦ���к�����ֵ����� |
| B����ϡ��Һ��1mol���1mol�Ӧ�ų������������ |
| C����ϡ��Һ��HCl��NaOH��Ӧ��HNO3��KOH�ķ�Ӧ���к������ |
| D����Ũ��������Թ���������������Һ�иպ�����1molˮʱ���������������к��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
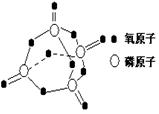
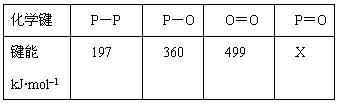
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com