
【题目】化学与生产和生活密切相关。下列过程中没有发生化学变化的是( )
A. 铁轨的锈蚀 B.铁粉、生石灰用于袋装食品的防腐及防潮
C. 枪支保存时涂层黄油防锈蚀 D.消防员戴着防毒面具(内装 Na2O2)救火
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是(NA表示阿伏加德罗常数的值)( )
A.30g乙烷含有的共价键数目为8NA
B.2.8g乙烯和丙烯的混合气体中所含碳原子数为0.2NA
C.1mol甲基含10 NA个电子
D.标况下,22.4L己烷完全燃烧后恢复至原状态,生成气态物质分子数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、F五种物质的焰色反应均为黄色,A、B、C、D与盐酸反应均生成E,此外B还生成一种可燃气体。而C、D还生成一种无色无味气体H,该气体能使澄清石灰水变浑浊。D和A可反应生成C,F和H也可反应生成C和另一种无色无味气体。请回答下列问题:
(1)写出A、B、C、D、E、F的化学式
A________;B________;C________;D________;E________;F________。
(2)写出F和H反应的化学方程式___________________。
(3)写出下列反应的离子方程式:
①D+盐酸____________________;
②B+水______________________;
③D+A_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过沉淀-氧化法处理含铬废水,减少废液排放对环境的污染,同时回收K2Cr2O7。实验室对含铬废液(含有Cr3+、Fe3+、K+、SO42-、NO3-和少量Cr2O72-)回收与再利用工艺如下:

已知:①Cr(OH)3 + OH- = CrO2- + 2H2O;
②2CrO2- + 3H2O2 + 2OH- = 2CrO42- + 4H2O;
③H2O2在酸性条件下具有还原性,能将+6价Cr还原为+3价Cr。
(1)如图是用KOH固体配制250mL 6 mol·L-1 KOH溶液的过程示意图。

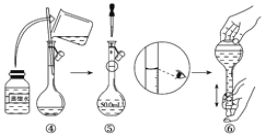
①请你观察图示判断,其中不正确的操作有(填序号)_____________________;
②其中配制250 mL溶液体积的容器是(填名称)_________________;
③如果用图示的操作配制溶液,所配制的溶液浓度将________(填“偏大”或“偏小”)。
(2)滤液Ⅰ酸化前,进行加热的目的是____________________________。冰浴、过滤后,应用少量冷水洗涤K2Cr2O7,其目的是_______。
(3)下表是相关物质的溶解度数据:
物质 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ | 100℃ |
KCl | 28.0 | 34.2 | 40.1 | 45.8 | 51.3 | 56.3 |
K2SO4 | 7.4 | 11.1 | 14.8 | 18.2 | 21.4 | 24.1 | K2Cr2O7 | 4.7 | 12.3 | 26.3 | 45.6 | 73.0 | 102.0 |
KNO3 | 13.9 | 31.6 | 61.3 | 106 | 167 | 246.0 |
根据溶解度数据,操作Ⅰ具体操作步骤为①________________②________________。
称取产品重铬酸钾试样2.000g配成250mL溶液,取出25.00mL于锥形瓶中,加入10mL 2mol·L-1H2SO4和足量碘化钠(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水, 加入3mL淀粉指示剂,用0.1200 mol·L-1Na2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)。
①写出重铬酸钾氧化碘化钠的离子方程式_______________________。
②滴定终点的现象为_________________________。
③若实验中共用去Na2S2O3标准溶液30.00mL,所得产品中的重铬酸钾的纯度 为_________(设整个过程中其它杂质不参与反应)。
④若滴定管在使用前未用Na2S2O3标准溶液润洗,测得的重铬酸钾的纯度将_____________(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,各烧杯中盛有海水,铁在其中被腐蚀的速度由快到慢的顺序为

A. ②①③④⑤⑥ B. ⑤④②①③⑥ C. ⑤②④①③⑥ D. ⑤③②④①⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中放入铝片后有氢气产生,则下列离子在该溶液中肯定不可以大量存在的是 ( )
A. Na+ B. Mg2+ C. OH- D. HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述实验设计或操作正确的是( )
选项 | 实验目的 | 实验设计 |
A | 除去铝箔上少量的氧化膜 | 将铝箔放入 NaOH 溶液中洗涤 |
B | 排水法收集 KMnO4 分解产生的 O2 | 先熄灭酒精灯,后移出导管 |
C | 检验溶液中是否含有 Fe2+ | 向溶液中滴入氯水后,再滴加 KSCN 溶液 |
D | 证明 H2SO4 酸性比 H2CO3 强 | 把稀 H2SO4 滴入 NaHCO3 溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(8分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)⑧的原子结构示意图为_________。
(2)②的气态氢化物分子的结构式为_______,②和⑦的气态氢化物的稳定性相比,其中较弱的是____(用该氢化物的化学式表示)。
(3)②、③的最高价含氧酸的酸性由强到弱的顺序是 (填化学式)。
(4)⑤、⑥元素的金属性强弱依次为___________(填“增大”、“减小”或“不变”)。
(5)④、⑤、⑥的形成的简单离子半径依次_________(填“增大”、“减小”或“不变”)。
(6)①、④、⑤元素可形成既含离子键又含共价键的化合物,写出它的电子式: ,形成的晶体是 晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一定条件下,x A+y B![]() z C的反应达到平衡。
z C的反应达到平衡。
①已知A、B、C都是气体,在减压后平衡向逆反应方向移动,则x、y、z之间的关系是__________________;
②已知C是气体,且x+y=z,在增大压强时,如果平衡发生移动,则平衡一定向_____________(填“正反应方向”或“逆反应方向”)移动;
③已知B、C是气体,当其他条件不变,增大A的物质的量时,平衡不发生移动,则A是_________(填“固”或“液”或“气”)态物质;
④若加热后C的质量分数减少,则正反应是_________(填“放热”或“吸热”)反应。
(2)二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。硫酸生产中,SO2催化氧化生成SO3的原理为:2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图所示。根据图示回答下列问题:

①将2.0mol SO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa。该反应的平衡常数等于______________。
②平衡状态由A变到B时,平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com