
A.2HgO 2Hg+O2↑ 2Hg+O2↑ |
B.4Al+3MnO2 2Al2O3+3Mn 2Al2O3+3Mn |
C.2AlCl3 2Al+3Cl2 ↑ 2Al+3Cl2 ↑ |
D.4CO+Fe3O4 3Fe+4CO2 3Fe+4CO2 |
 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源:不详 题型:单选题
| A.在接触室中使用铁粉作催化剂 |
| B.在接触室中运用热交换技术可充分利用能源 |
| C.把硫铁矿磨成细粉末,可以提高原料的利用率 |
| D.该反应采用450~500°C主要是因为该温度下催化剂活性好 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
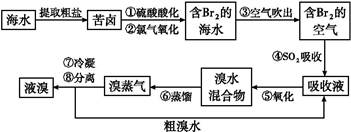
 2H++2Br-+S
2H++2Br-+S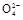
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.3MnO2 + 4Al 3Mn + 2Al2O3 3Mn + 2Al2O3 | B.2AlCl3(熔融)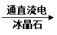 2Al + 3Cl2 2Al + 3Cl2 |
C.Fe2O3 + 3CO 2Fe + 3CO2 2Fe + 3CO2 | D.2HgO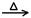 2Hg+ O2↑ 2Hg+ O2↑ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
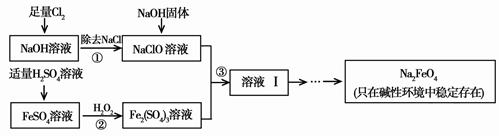
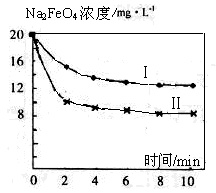
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
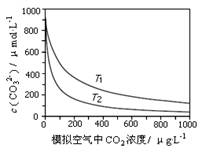
| A.T1>T2 |
| B.海水温度一定时,大气中CO2浓度增加,海水中溶解的CO2随之增大,导致CO32-浓度降低 |
| C.当大气中CO2浓度确定时,海水温度越高,CO32- 浓度越低 |
| D.大气中CO2含量增加时,海水中的珊瑚礁将逐渐溶解 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
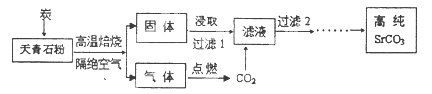
 SrSO4(s)+CO
SrSO4(s)+CO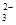 (aq) SrCO3(s)+SO
(aq) SrCO3(s)+SO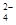 (aq)
(aq)查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 冶炼原理 | 方法 |
| A | 2HgO 2Hg + O2 ↑ 2Hg + O2 ↑ | 热分解法 |
| B | 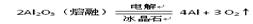 | 电解法 |
| C | Cu2S+ O2 2Cu + SO2 2Cu + SO2 | 热分解法 |
| D | Fe2O3 + 2Al 2 Fe + Al2O3 2 Fe + Al2O3 | 热还原法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com