
【题目】现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | 最外层电子占核外电子总数的3/8 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 元素最高正价是+7价 |
(1)元素X的一种同位素可测定文物年代,该同位素中子数为8,这种同位素的符号是 .
(2)Y的氢化物与Y的最高价氧化物的水化物反应生成的物质名称为:
(3)Z所在族元素的四种氢化物中,沸点最低的物质的化学式为:
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是 (填分子式),阐述理由是 .
【答案】(1)14C;
(2)硝酸铵;
(3)HCl;
(4)H2CO3;碳酸为弱酸,其余三种酸为强酸.
【解析】试题分析:T最外层电子占核外电子总数的![]() ,T元素最外层共有6个电子,原子核外应有16个电子,为S元素;X最外层电子数是次外层的两倍,因此X次外层为2个电子,最外层为4个电子,是C元素,能用于测定文物年代的是具有放射性的;Y单质是双原子分子,且其氢化物水溶液显碱性,可知Y是N元素;元素Z最高正价是+7价,因此Z是Cl,Cl所在族元素的四种氢化物分别为HF、HCl、HBr、HI,其中HF中含有氢键;T、X、Y、Z四种元素的最高价氧化物的水化物分别为H2CO3、H2SO4、HNO3、HClO4,除了碳酸是弱酸,其余均为强酸,据此进行解答.
,T元素最外层共有6个电子,原子核外应有16个电子,为S元素;X最外层电子数是次外层的两倍,因此X次外层为2个电子,最外层为4个电子,是C元素,能用于测定文物年代的是具有放射性的;Y单质是双原子分子,且其氢化物水溶液显碱性,可知Y是N元素;元素Z最高正价是+7价,因此Z是Cl,Cl所在族元素的四种氢化物分别为HF、HCl、HBr、HI,其中HF中含有氢键;T、X、Y、Z四种元素的最高价氧化物的水化物分别为H2CO3、H2SO4、HNO3、HClO4,除了碳酸是弱酸,其余均为强酸,据此进行解答.
解:T最外层电子占核外电子总数的![]() ,T元素最外层共有6个电子,原子核外应有16个电子,为S元素;X最外层电子数是次外层的两倍,因此X次外层为2个电子,最外层为4个电子,是C元素;Y单质是双原子分子,且其氢化物水溶液显碱性,可知Y是N元素;元素Z最高正价是+7价,因此Z是Cl,
,T元素最外层共有6个电子,原子核外应有16个电子,为S元素;X最外层电子数是次外层的两倍,因此X次外层为2个电子,最外层为4个电子,是C元素;Y单质是双原子分子,且其氢化物水溶液显碱性,可知Y是N元素;元素Z最高正价是+7价,因此Z是Cl,
(1)元素X为C,其同位素原子有12C、14C,其中14C具有放射性,常用于测定文物年代,
故答案为:14C;
(2)Y是N元素,氢化物与最高价氧化物的水化物反应生成的物质为硝酸铵,
故答案为:硝酸铵;
(3)Cl所在族元素的四种氢化物分别为HF、HCl、HBr、HI,其中HF含有氢键,沸点最高,其它三种氢化物都属于分子晶体,氢化物的相对分子质量越大,分子间作用越强,则氢化物的沸点越高,HCl的相对分子质量最小,则HCl的沸点最低,
故答案为:HCl;
(4)T、X、Y、Z四种元素的最高价氧化物的水化物分别为H2CO3、H2SO4、HNO3、HClO4,除了碳酸是弱酸,其余均为强酸,
故答案为:H2CO3;碳酸为弱酸,其余三种酸为强酸.


科目:高中化学 来源: 题型:
【题目】某化合物由两种单质直接反应生成,将其加入Ba(HCO3)2溶液中同时有气体和沉淀产生。下列化合物中符合上述条件的是:
A.AlCl3 B.Na2O C.FeCl2 D.SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读、分析下列两个材料:
材料一
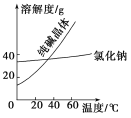
材料二
物质 | 熔点/℃ | 沸点/℃ | 密度/ g/cm3 | 溶解性 |
乙二醇(C2H6O2) | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
丙三醇(C3H8O3) | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
常见的分离方法有以下几种:
A.蒸馏法
B.萃取法
C.“溶解、过滤、结晶”的方法
D.分液法
根据上述材料,回答下列问题(填序号):
(1)将纯碱从氯化钠和纯碱的混合物中分离出来,最好应用________;
(2)将乙二醇和丙三醇相互分离的最佳方法是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饮食是保证我们身体健康的基本需求,下列关于饮食的说法正确的是( )
A.鸡蛋含有丰富的蛋白质,人类需要的蛋白质都可以由鸡蛋提供,多吃有益
B.水果、蔬菜含有丰富的维生素,有人为了减肥,每天只吃水果蔬菜即可
C.要促进身体健康,各种饮食必须合理搭配
D.米饭含有大量的淀粉,成人每天食用量不能超过200 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙、丙、丁、戊五种短周期元素,原子序数依次增大,其常见化合价依次为+1、-2、+1、+3、-1。它们形成的物质间的转化关系如下图所示。常温下用惰性电极电解(有阳离子交换膜)1L l mol/L的A溶液。

请按要求回答下列问题:
(1)己元素与丙元素同主族,比丙原子多2个电子层,则己的原予序数为_____________;推测相同条件下丙、己单质分别与水反应剧烈程度的依据是____________________。
(2)甲、乙、戊按原予个数比1:1:1形成的化合物Y具有漂白性,其电子式为___________。
(3)上图转化关系中不属于氧化还原反应的有(填编号)____________。
(4)接通右图电路片刻后,向烧杯中滴加一种试剂即可检验铁电极被腐蚀,此反应的离子方程式为______。

(5)当反应①电解一段时间后测得D溶液pH=12(常温下,假设气体完全逸出,取出交换膜后溶液充分混匀,忽略溶液体积变化),此时共转移电子数目约为________;反应②的离子方程式为_______________。
(6)若上图中各步反应均为恰好完全转化,则混合物X中含有的物质(陈水外)有_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食品卫生与人们身体健康密切相关,下列做法符合《食品卫生法》的是( )
A.用工业用盐腌制咸菜 B.在牛奶中添加尿素
C.用二氧化硫熏制银耳 D.用纯碱发酵面食
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列应用不涉及氧化还原反应的是( )
A.Na2O2用作呼吸面具的供氧剂 B.工业上电解熔融状态的Al2O3制备Al
C.工业上利用合成氨实现人工固氮 D.实验室用NH4Cl和Ca(OH)2制备NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学组装了如图所示的电化学装置,则下列说法正确的是( )
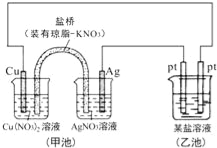
A.图中甲池为原电池装置,Cu电极发生还原反应
B.实验过程中,甲池左侧烧杯中NO3﹣的浓度不变
C.若甲池中Ag电极质量增加5.4g时,乙池某电极析出1.6g金属,则乙中的某盐溶液可能是AgNO3溶液
D.若用铜制U形物代替“盐桥”,工作一段时间后取出U形物称量,质量会减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验现象,所得结论错误的是
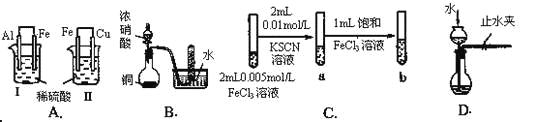
实验 | 实验现象 | 结论 |
A | Ⅰ烧杯中铁片表面有气泡,Ⅱ烧杯中铜片表面有气泡 | 活动性:Al>Fe>Cu |
B | 试管中收集到无色气体 | 铜与浓硝酸反应产物是NO |
C | 试管b比试管a中溶液的红色深 | 增大反应物浓度,平衡向正反应方向移动 |
D | 长颈漏斗内液面高于烧瓶内液面且保持不变 | 装置气密性良好 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com