
【题目】在一个体积恒定的密闭容器中,加入2 mol A和1 mol B发生反应:2A(g)+B(g)![]() 3C(g)+D(g),一定条件下达到平衡时,C的浓度为W mol·L1,若容器体积和温度保持不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍为W mol·L1的是
3C(g)+D(g),一定条件下达到平衡时,C的浓度为W mol·L1,若容器体积和温度保持不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍为W mol·L1的是
A.4 mol A+2 mol B
B.3 mol C+1 mol D
C.2 mol A+1 mol B+3 mol C+1 mol D
D.1 mol A+0.5 mol B+3 mol C+1 mol D
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
【题目】下表是周期表中的一部分,根据A﹣I在周期表中的位置,第(1)~(4)小题用元素符号或化学式回答,(5)~(8)小题按题目要求回答.
族 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
1 | A | |||||||
2 | D | E | G | I | ||||
3 | B | C | F | H |
(1)表中元素,化学性质最不活泼的是 , 只有负价而无正价的是 , 氧化性最强的单质是 , 还原性最强的单质是 .
(2)最高价氧化物的水化物碱性最强的是 , 酸性最强的是 , 呈两性的是 .
(3)A分别与D,E,F,G,H形成的化合物中,最稳定的 ,
(4)在B,C,E,F,G,H中,原子半径最大的是 ,
(5)A和D组成最简单化合物的电子式 ,
(6)A和E组成化合物的化学式 ,
(7)用电子式表示B和H组成化合物的形成过程: .
(8)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有________________________________________________。
(2)硫酸铜溶液可以加快氢气生成速率的原因是__________________________________________。
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是________;
(4)要加快上述实验中气体产生的速率,还可采取的措施有______________(答两种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需的时间。
A | B | C | D | E | F | |
4 mol·L-1H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V1=________,V6=________,V9=________。
②反应一段时间后,实验E中的金属呈________色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中,既能发生水解反应,又能发生加成反应,但不能发生消去反应的是( )
A.CH2=CH—CH2CH2ClB.CH2=CHCH2COOCH3
C.CH3CHClCH=CH2D.(CH3)3CCH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸广泛用于医药、食品、染料、化工等领域。以下是实验室制备苯甲酸的一种方法。反应原理:
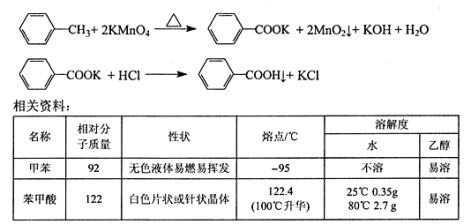

实验步骤:
①下图组装反应装置(冷凝水、夹持及加热装置未画出),并在三颈烧瓶中依次加入120mL水、稍过量高锰酸钾和3.0mL甲苯(密度为0.866g/ mL)。
②将三颈烧瓶中的混合液体搅拌、加热至沸腾,直到甲苯完全反应。
③趁热过滤反应混合物。若滤液呈紫色,则需加入适量的亚硫酸氢钠溶液至紫色褪去后再过滤,用热水洗涤滤渣,洗涤液合并至滤液中。
④用冰水冷却滤液,然后用浓盐酸酸化,过滤,用少量冷水洗涤滤渣,得到苯甲酸粗产品,经重结晶得到精制的苯甲酸。
回答下列问题:
(1)仪器 a名称为 。
(2)判断甲苯己完全反应的现象是 、回流液不再出现油珠。
(3)实验步骤④中,用少量冷水而不用热水洗涤滤渣的目的是 ;苯甲酸粗产品除了可用重结晶法精制外,还可用 法。
(4)精制的苯甲酸纯度测定:称取1.220g样品,用稀乙醇溶解并配成100 mL溶液,分别取25.00mL溶液,用0.1000 mo1·L-1NaOH标准溶液滴定,三次滴定消耗NaOH溶液的体积分别为V1=22.48mL.V2=22.52 mL.V3= 23.80mL。
①配制溶液时用稀乙醇而不用蒸馏水作溶剂的原因是 。
②若用酚酞作指示剂,确定滴定终点的现象是 。
③产品的纯度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C,D四种短周期元素,原子序数D>A>B>C,且A,B同周期,C,D同主族,A的原子结构示意图为: 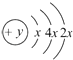 ,B最外层电子数是2,C的气态氢化物的水溶液呈碱性,据此填空:
,B最外层电子数是2,C的气态氢化物的水溶液呈碱性,据此填空:
(1)A的元素名称为 , 其气态氢化物的稳定性比CH4(填“强”或“弱”).
(2)C,D的最高价氧化物的水化物的酸性大小为>(填化学式).
(3)B的活泼性比钙的(填“强”或“弱”).
(4)写出C的气态氢化物与其最高价氧化物对应的水化物反应 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在相同条件下,2mol C燃烧生成2mol CO放出的热量为Q1 , 2mol C 燃烧生成2mol CO2放出的热量为Q2 , Q1和Q2的关系是( )
A.Q1=Q2
B.Q1>Q2
C.Q1<Q2
D.无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com