
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原电池是把电能转化为化学能的装置 |
| B、在内电路中,电子由正极流向负极 |
| C、原电池工作时,正极表面一定有气泡产生 |
| D、原电池工作时,可能会伴随着热量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| V |
| 10 |
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0 | B、+1 | C、+3 | D、+4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
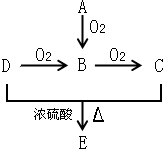 已知A、B、C、D和E五种有机物存在如图所示的转化关系.A是一种标准状况下密度为1.25g.L-1的烃,E是一种有水果香味的有机物.
已知A、B、C、D和E五种有机物存在如图所示的转化关系.A是一种标准状况下密度为1.25g.L-1的烃,E是一种有水果香味的有机物.查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定 次数 | 待测溶液的 体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.04 | 21.03 |
| 2 | 25.00 | 1.98 | 21.99 |
| 3 | 25.00 | 3.20 | 21.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com