
【题目】颠茄酸酯(H)有解除胃肠道痉挛、抑制胃酸分泌的作用,常用于胃肠道平滑肌痉挛及溃疡病的辅助治疗,其合成路线如下:
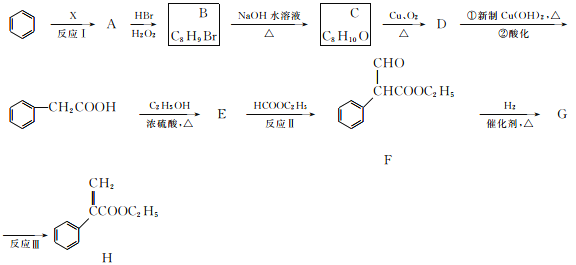
试回答下列问题:
(1)反应Ⅰ所涉及的物质均为烃,氢的质量分数均为7.69%,A的相对分子质量小于110,则A的化学名称为________,A分子中最多有________个碳原子在一条直线上。
(2)反应Ⅱ的反应类型是________,反应Ⅲ的反应类型是________。
(3)B的结构简式是________;E的分子式为________;F中含氧官能团的名称是________。
(4)C→D反应的化学方程式为____________________________________________________________。
(5)化合物G有多种同分异构体,同时满足下列条件的有________种。
①能发生水解反应和银镜反应;②能与![]() 发生显色反应;③苯环上有四个取代基,且苯环上一卤代物只有一种。
发生显色反应;③苯环上有四个取代基,且苯环上一卤代物只有一种。
(6)参照上述合成路线,设计一条由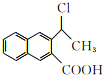 制备
制备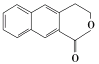 的合成路线_______________。
的合成路线_______________。
【答案】苯乙烯 3 取代反应 消去反应 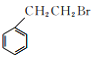 C10H12O2 醛基、酯基 2
C10H12O2 醛基、酯基 2 6
6 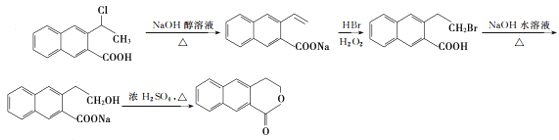
【解析】
根据合成线路可知,D与新制Cu(OH )2加热条件下反应,酸化后得苯乙酸,则D的结构简式为:![]() ;C催化氧化生成D,则C的结构简式为:
;C催化氧化生成D,则C的结构简式为:![]() ;B水解生成C,则B的结构简式为:
;B水解生成C,则B的结构简式为:![]() ;A与溴化氢在双氧水的作用下发生加成反应生成B,所以A为苯乙烯,反应Ⅰ所涉及的物质均为烃,氢的质量分数均相同,比较苯与A的结构可知,苯与X发生加成反应生成A,所以X为CH≡CH,苯乙酸与乙醇在浓硫酸作用下发生酯化反应生成E为
;A与溴化氢在双氧水的作用下发生加成反应生成B,所以A为苯乙烯,反应Ⅰ所涉及的物质均为烃,氢的质量分数均相同,比较苯与A的结构可知,苯与X发生加成反应生成A,所以X为CH≡CH,苯乙酸与乙醇在浓硫酸作用下发生酯化反应生成E为![]() ,E发生取代反应生成F,F与氢气发生加成,醛基转化为羟基,则G的结构简式为:
,E发生取代反应生成F,F与氢气发生加成,醛基转化为羟基,则G的结构简式为:![]() ,G发生消去反应生成H,由
,G发生消去反应生成H,由 制备
制备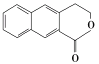 ,可以用
,可以用 依次通过消去反应得到碳碳双键,在H2O2条件下与HBr加成,Br在端点的C原子上,水解反应生成-OH,然后发生酯化反应得最终产物,据此进行解答。
依次通过消去反应得到碳碳双键,在H2O2条件下与HBr加成,Br在端点的C原子上,水解反应生成-OH,然后发生酯化反应得最终产物,据此进行解答。
(1)根据上面的分析可知,A为苯乙烯,苯乙烯分子中处于对位的最多有3个碳原子在一条直线上,故答案为苯乙烯;3;
(2) 根据上面的分析可知,反应Ⅱ的反应类型是取代反应,反应Ⅲ的反应类型是消去反应,故答案为取代反应;消去反应;
(3)B的结构简式为:![]() ,E为
,E为![]() ,E的分子式为 C10H12O2,根据F的结构简式可知,F中含氧官能团的名称是醛基、酯基,
,E的分子式为 C10H12O2,根据F的结构简式可知,F中含氧官能团的名称是醛基、酯基,
故答案为![]() ;C10H12O2;醛基、酯基;
;C10H12O2;醛基、酯基;
(4)由C→D反应是![]() 催化氧化,反应的化学方程式为
催化氧化,反应的化学方程式为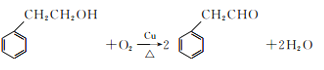 ,
,
故答案为2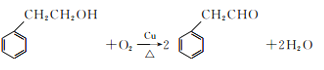 ;
;
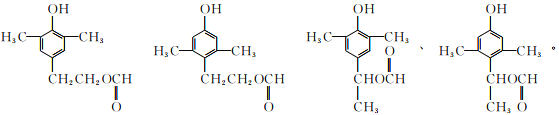
(5)化合物G的同分异构体中含有酚羟基、甲酸酯基,残基含有4个饱和碳原子;结合条件③可写出6种符合条件的同分异构体的结构简式: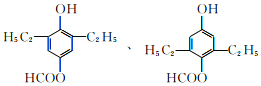
(6) 参照上述合成路线,设计一条由 制备
制备 的合成路线流程:
的合成路线流程: 。
。


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2))是一种在水处理等方面有广泛应用的高效安全消毒剂,而且与Cl2相比不会产生对人体有潜在危害的有机氯代物。某课题组以惰性电极电解盐酸和NH4Cl的混合溶液获得NCl3溶液,再以NCl3溶液和NaClO2反应制得ClO2。回答下列问题:
(1)ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH的关系如图所示:
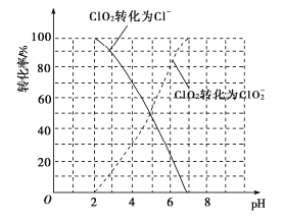
①pH≤2时,ClO2与I-反应生成I2的离子方程式为_________________。
②在用ClO2进行水处理时,除了杀菌消毒外,还能除去水中的Fe2+和Mn2+,ClO2氧化Mn2+生成MnO2的反应中,氧化剂和还原剂的物质的量之比为________。
(2)NCl3的水解产物有NHCl2、NH2Cl等。
①NCl3的电子式为________,其中氯元素的化合价是________;NH2Cl仍可缓慢发生水解,其化学方程式为_________________。
②NCl3在NaOH溶液中水解生成N2,NaClO和NaCl,其化学方程式为______________。
③NCl3与NaClO2按物质的量之比1∶6混合,在溶液中恰好反应生成ClO2和氨,该反应的离子方程式为___________________。
(3)有下列两种方法制备ClO2:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O
用方法二制备的ClO2更适合用于饮用水消毒,其主要原因是_______________。
(4)电解获得NCl3溶液的化学方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)![]() Mg2+(aq)+2OH—(aq)
Mg2+(aq)+2OH—(aq)
B.NaHS溶液中存在电离平衡:HS—+H2O![]() H2S+OH-
H2S+OH-
C.NaHCO3溶液中存在水解平衡:HCO3—+H2O![]() OH—+H2CO3
OH—+H2CO3
D.反应:Cr2O72—+ H2O![]() 2CrO42—+2H+,其平衡常数K=
2CrO42—+2H+,其平衡常数K=
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是
A.使酚酞变红色的溶液:K+、Fe3+、SO42-、Cl-
B.水电离的c(H+)=1×10-13mol/L的溶液中:K+、Na+、AlO2-、CO32-
C.与Al反应能放出H2的溶液中:Fe2+、Na+、NO3-、SO42-
D.![]() = 1×10-13mol/L的溶液中:NH4+、Cu2+、Cl-、NO3-
= 1×10-13mol/L的溶液中:NH4+、Cu2+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g)。设起始
CO(g)+3H2(g)。设起始![]() =Z,在恒压下,平衡时
=Z,在恒压下,平衡时![]() (CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
(CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
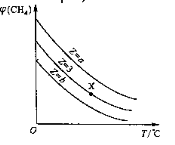
A.该反应的焓变ΔH<0
B.图中Z的大小为b>3>a
C.图中X点对应的平衡混合物中![]() =3
=3
D.温度不变时,图中X点对应的平衡在加压后![]() (CH4)减小
(CH4)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是常用的消毒剂、除臭剂、水质净化剂以及强氧化剂,下图是在实验室中制备KMnO4晶体的流程:
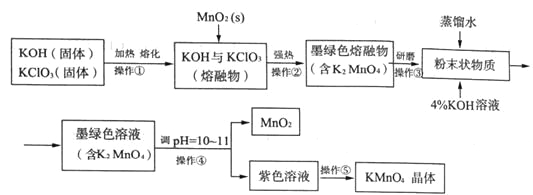
回答下列问题:
(1)操作②目的是获得K2MnO4,同时还产生了KCl和H2O,试写出该步反应的化学方程式: _______________。操作①和②均需在坩埚中进行,根据实验实际应选择_______________(填序号)。
a.瓷坩埚 b.氧化铝坩埚 c.铁坩埚 d.石英坩埚
(2)操作④是使K2MnO4转化为KMnO4和MnO2,该转化过程中发生反应的离子方程式为_______________。若溶液碱性过强,则MnO4-又会转化为MnO42-,该转化过程中发生反应的离子方程式为_______________。因此需要通入某种气体调pH=10-11,在实际操作中一般选择CO2而不是HCl,原因是_______________。
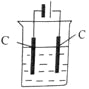
(3)操作⑤过滤时,选择图2所示装置而不用图1所示装置的原因是_______________。

(4)还可采用电解K2MnO4溶液(绿色)的方法制造KMnO4(电解装置如图所示),电解过程中右侧石墨电极的电极反应式为_______________。溶液逐渐由绿色变为紫色。但若电解时间过长,溶液颜色又会转变成绿色,可能的原因是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电-Fenton法是用于水体中有机污染物降解的高级氧化技术,反应原理如图所示。电解产生的H2O2与Fe2+发生反应生成的羟基自由基(·OH)能氧化降解有机污染物。下列说法错误的是

A.电源的A极为负极
B.与电源B极相连电极的电极反应式为H2O-e- =H++·OH
C.Fenton反应为:H2O2+Fe2+=Fe(OH)2++·OH
D.每消耗2.24LO2(标准状况),整个电解池中理论上可产生的·OH为0.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组在实验室对酸碱中和反应进行探究
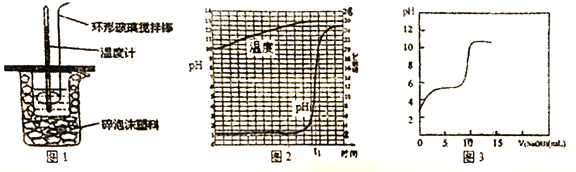
(1)中和热的测定:用50mL 0.5mol/L 的盐酸与50mL 0.55mol/L 的NaOH溶液在如图1所示装置中进行中和热测定,若用等体积等浓度的醋酸代替盐酸,测得中和热数值____。(填“偏大”、“偏小”或“无影响”)
(2)中和滴定:取一定量的稀盐酸,逐滴滴加NaOH溶液,边滴加边振荡。
①指示剂法:用___________(填仪器名称)取一定体积的稀盐酸于锥形瓶中,滴加几滴甲基橙作指示剂,滴定达到终点的现象为__________。
②传感器法:用传感器实时获得溶液的pH、温度曲线如图2所示,当反应达到终点时,溶液的温度为____℃。若用等浓度的醋酸代替稀盐酸,用传感器实时获得溶液的pH如图3所示,图2与图3中溶液起始pH后者较大的原因是__________,图3中反应终点时溶液pH约为8,请用离子方程式表示其原因________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是
A.标准状况下,![]() L的C2H4和C3H6的混合物中含有的碳碳双键数目为NA
L的C2H4和C3H6的混合物中含有的碳碳双键数目为NA
B.100g质量分数17%H2O2溶液中极性键数目为NA
C.1L0.1molK2Cr2O7溶液中含铬的离子总数为0.2NA
D.65gZn溶于浓硫酸中得混合气体的分子数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com