
【题目】(1)在含有AlO2—溶液中通入足量CO2 ,写出反应的离子方程式____________
(2)Al2O3在碳的还原作用下生成铝的气态低价氧化物X (X中Al与O的质量比为6.75∶2)则X的化学式为_________。
(3)三氟化氮(NF3)是一种无色、无臭的气体。三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,反应产物中生成酸M、酸N和一种无色气体(遇空气变成红棕色),其中酸M是一种弱酸,酸N为常见的含氧强酸。
① 写出该反应的化学方程式_________。
② 酸M是弱酸(难电离)的原因是____________
③一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除NaNO3、NaF等盐外,还可以生成的盐是____________(填化学式)。
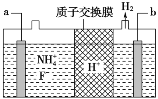
④在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如图所示。写出a电极的电极反应式________。
【答案】AlO2-+CO2+2H2O=Al(OH)3+HCO3- Al2O 3NF3+5H2O=2NO+HNO3+9HF H—F键键能大,结合能力强; HF与HF有氢键 NaNO2 NH4++3F--6e-=NF3+4H+
【解析】
(1)在含有AlO2-溶液中通入足量CO2 生成氢氧化铝沉淀和碳酸氢盐;
(2)设X的化学式是AlmOn,根据铝和氧的质量比计算m、n的比值;
(3)三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,生成一种无色气体(遇空气变成红棕色),该气体是NO;生成M是一种弱酸,M是HF,N为常见的含氧强酸,N是硝酸; NH4F→NF3,N原子失电子发生氧化反应;
(1)在含有AlO2—溶液中通入足量CO2生成氢氧化铝沉淀和碳酸氢盐,反应的离子方程式是AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(2)设X的化学式是AlmOn,则![]() ,所以
,所以![]() ;X的化学式是Al2O;
;X的化学式是Al2O;
(3)①三氟化氮核水蒸气反应生成NO、HF、HNO3,该反应的化学方程式是3NF3+5H2O=2NO+HNO3+9HF;
②H—F键键能大,结合氢原子能力强,HF与HF分子间有氢键,所以HF酸难电离;
③NF3水解生成的NO与氧气反应生成NO2,NO2与氢氧化钠溶液反应生成NaNO3、NaNO2、H2O,所以其产物除NaNO3、NaF等盐外,还可以生成的盐是NaNO2。
④NH4F→NF3,N原子失电子发生氧化反应,b极放出氢气,所以b是阴极,a是阳极,阳极发生氧化反应,所以a极反应式是NH4++3F--6e-=NF3+4H+。


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,其主要过程如下图所示。

已知:几种物质中化学键的键能如下表所示。
化学键 | H2O中H—O键 | O2中O=O 键 | H2中H—H键 | H2O2中O—O键 | H2O2中O—H键 |
键能kJ/mol | 463 | 496 | 436 | 138 | 463 |
若反应过程中分解了2 mol水,则下列说法不正确的是
A. 总反应为2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
B. 过程I吸收了926 kJ能量
C. 过程II放出了574 kJ能量
D. 过程Ⅲ属于放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入350mL 2molL﹣1的稀硝酸恰好使混合物完全溶解,放出2.24L NO(标准状况),往所得溶液中加入KSCN溶液,无红色出现.若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为( )
A. 0.21 molB. 0.25 molC. 0.3 molD. 0.35 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用O2将HCl转化为Cl2,反应方程式为:4HCl(g) + O2(g)![]() 2H2O(g)+ 2Cl2(g)+Q(Q>0)一定条件下测得反应过程中n(Cl2)的实验数据如下。下列说法正确的是( )
2H2O(g)+ 2Cl2(g)+Q(Q>0)一定条件下测得反应过程中n(Cl2)的实验数据如下。下列说法正确的是( )
t/min | 0 | 2 | 4 | 6 |
n(Cl2)/10-3 mol | 0 | 1.8 | 3.7 | 5.4 |
A.0~2 min的反应速率小于4~6 min的反应速率
B.2~6 min用Cl2表示的反应速率为0.9 mol/(L·min)
C.增大压强可以提高HCl转化率
D.平衡常数K(200℃)<K(400℃)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年,我国科学家屠呦呦因在青蒿素发现和治疗中的贡献,获得了诺贝尔生理学或医学奖。由植物黄花蒿叶中提取的青蒿素还可合成用于抗氯喹恶性疟及凶险型疟疾的蒿甲醚,其合成路线如下:
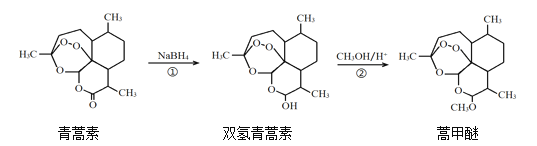
下列说法正确的是( )
A.青蒿素的分子式是C15H21O4
B.青蒿素在NaOH溶液中可以发生水解反应
C.反应②有H2O生成
D.反应①氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种用途广泛的化工原料,也可作为燃料。请回答以下问题:
(1)工业上常用下列反应制备甲醇:CO(g) + 2H2(g) ![]() CH3OH(g) ΔH= —90.1KJmol-1,该反应自发的条件是________。
CH3OH(g) ΔH= —90.1KJmol-1,该反应自发的条件是________。
(2)实验室模拟用CO和H2反应来制甲醇。在250℃下,将一定量的CO和H2投入2L的密闭容器中,各物质的物质的量(mol)变化如下表所示:(前6min没有改变条件)
2min | 4min | 6min | 8min | 20min | … | |
CO | 0.7 | 0.5 | 0.5 | 0.4 | 0.2 | … |
H2 | 1.4 | 1 | 1 | 1.8 | 2 | … |
CH3OH | 0.3 | 0.5 | 0.5 | 0.6 | 0.8 | … |
①从0min-4min这段时间的反应速率v(CO)=_________
②250℃时该反应平衡常数K的值为________。
③若第6min时只改变了一个条件,则所改变的条件是________。
④若反应过程中保持温度不变,第20min时,该反应的v正______v逆。(填“ > ”,“ < ”或“ = ”)
(3)若在一恒容的密闭容器中通入物质的量之比为1:1的CO和H2来生产CH3OH,画出不同温度下,反应相同时间时CO的体积分数随温度变化的图像。_______________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,某溶液中由水电离出的c(H+)=l ×10-13 mol·L-1,下列说法正确的是
A.在该溶液中一定能同时大量存在Cu2+、NO3-、Cl-、Na+等离子
B.在该溶液中有可能同时大量存在K+、NO3-、HCO3-、Na+等离子
C.该溶液的pH可能为13,也可能为1
D.该溶液中 c(OH-)=l×10-1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应2Ag+Cl2=2AgCl设计的一种原电池的装置如图。下列说法正确的是
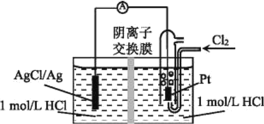
A.负极反应为Cl2+2e-=2Cl-
B.放电时,离子交换膜右侧溶液中有白色沉淀生成
C.理论上,可以用NaCl溶液代替盐酸
D.当电路中有0.01 mole-转移时,交换膜左侧溶液中约减少0.02 mol离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是___。
a.原子半径和离子半径均减小 b.金属性减弱,非金属性增强
c.单质的熔点降低 d.氧化物对应的水合物碱性减弱,酸性增强
(2)原子最外层电子数与次外层电子数相同的元素名称为___,氧化性最弱的简单阳离子是___。
(3)已知:
化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是___;制铝时,电解Al2O3而不电解AlCl3的原因是___。
(4)晶体硅(熔点1410℃)是良好的半导体材料.由粗硅制纯硅过程如下:
Si(粗)![]() SiCl4
SiCl4![]() SiCl4(纯)
SiCl4(纯)![]() Si(纯)
Si(纯)
写出SiCl4的电子式:___;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程式___。
(5)下列气体不能用浓硫酸干燥,可用P2O5干燥的是___。
a.NH3 b.HI c.SO2 d.CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1.写出该反应的化学方程式:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com