
【题目】常温下,某溶液中由水电离出的c(H+)=l ×10-13 mol·L-1,下列说法正确的是
A.在该溶液中一定能同时大量存在Cu2+、NO3-、Cl-、Na+等离子
B.在该溶液中有可能同时大量存在K+、NO3-、HCO3-、Na+等离子
C.该溶液的pH可能为13,也可能为1
D.该溶液中 c(OH-)=l×10-1 mol·L-1
【答案】C
【解析】
常温下,纯水中由水电离出的c(H+)=l ×10-7mol·L-1,而该溶液中由水电离出的c(H+)=l ×10-13 mol·L-1,说明水的电离受到抑制,其抑制原因可能是溶液中存在大量H+或OH-,即溶液可能为酸性,也可能为碱性,据此分析。
A.若该溶液中存在大量OH-,Cu2+与OH-会反应生成Cu(OH)2沉淀,不能大量共存,若溶液中存在大量H+,Cu2+、NO3-、Cl-、Na+等离子与H+均不发生反应能够大量共存,故A不符合题意;
B.![]() 与H+或OH-均不能大量共存,因此在该溶液中一定不能大量共存,故B不符合题意;
与H+或OH-均不能大量共存,因此在该溶液中一定不能大量共存,故B不符合题意;
C.若该溶液中H+全部由水电离,则溶液中c(H+)=l ×10-13 mol·L-1,溶液pH=13,若溶液中OH-全部由水电离,即溶液中c(OH-)=l ×10-13 mol·L-1,溶液中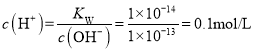 ,溶液pH=1,故C符合题意;
,溶液pH=1,故C符合题意;
D.由C分析可知,溶液中c(OH-)=l ×10-13 mol·L-1或c(OH-)=0.1 mol·L-1,故D不符合题意;
故答案为:C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】制烧碱所用盐水需两次精制。
第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、Fe3+、SO42-等离子,过程如下:
Ⅰ.向粗盐水中加入过量BaCl2溶液,过滤;
Ⅱ.向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ.滤液用盐酸调节pH,获得一次精制盐水。
已知:过程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20℃/g)如表:
完成下列填空:
CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
(1)过程Ⅰ除去的离子是_______________。
(2)检测Fe3+是否除尽的方法是____________________。
(3)过程Ⅰ选用BaCl2而不选用CaCl2,请运用表中数据解释原因______________。
(4)除去Mg2+的离子方程式是________________。
(5)检测Ca2+、Mg2+、Ba2+是否除尽时,只需检测Ba2+即可,原因是_____________。
第二次精制要除去微量的I-、IO3-、NH4+、Ca2+、Mg2+,流程示意如图:
(6)过程Ⅳ除去的离子是__________________。
(7)过程VI中,在电解槽的阴极区生成NaOH,结合化学平衡原理解释___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硅(Si3N4)是一种重要的陶瓷材料,可用石英与焦炭在1400~1450℃的氮气气氛下合成:3SiO2(s)+6C(s)+2N2(g)![]() Si3N4(s)+6CO(g)-Q(Q>0)。在一定条件下,向10L密闭容器中加入反应物,10min后达到平衡。
Si3N4(s)+6CO(g)-Q(Q>0)。在一定条件下,向10L密闭容器中加入反应物,10min后达到平衡。
完成下列填空:
(1)上述反应所涉及的元素,原子半径由大到小的顺序是_____。其中一种元素的原子核外s电子数与p电子数相等,写出它的核外电子排布式______。
(2)上述反应混合物中的极性分子是______,写出非极性分子的电子式______。分析用氮化硅制造轴承和发动机中耐热部件的原因是:______。
(3)下列措施可以提高二氧化硅转化率的是______(选填编号)。
a.增加焦炭用量 b.升高反应温度
c.增大气体压强 d.向反应容器中多充入氮气
(4)下列描述中能说明反应已达平衡的是______(选填编号)。
a.c(CO)=3c(N2) b.v(CO)=3v(N2)
c.容器内气体的密度不变 d.气体的压强保持不变
(5)该反应的平衡常数为____,平衡后增加氮气浓度,平衡向______(填“正反应”或“逆反应”)方向移动,K值____(填“变大”“变小”或“不变”)。若测得平衡时气体质量增加了11.2g,则用氮气表示的平均反应速率为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在含有AlO2—溶液中通入足量CO2 ,写出反应的离子方程式____________
(2)Al2O3在碳的还原作用下生成铝的气态低价氧化物X (X中Al与O的质量比为6.75∶2)则X的化学式为_________。
(3)三氟化氮(NF3)是一种无色、无臭的气体。三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,反应产物中生成酸M、酸N和一种无色气体(遇空气变成红棕色),其中酸M是一种弱酸,酸N为常见的含氧强酸。
① 写出该反应的化学方程式_________。
② 酸M是弱酸(难电离)的原因是____________
③一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除NaNO3、NaF等盐外,还可以生成的盐是____________(填化学式)。
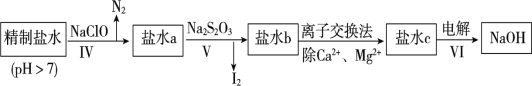
④在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如图所示。写出a电极的电极反应式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
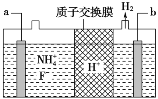
【题目】从含锌矿渣中提取制备锌白(ZnO)有多种方法,其中氨一碳酸氢铵法的优点是成本低。请根据以下材料,回答问题:
材料1:某矿渣的主要成份为ZnO、Fe2O3、PbO、MnO、CuO、SiO2。
材料2:主要反应原理:ZnO+NH4HCO3+3NH3=Zn(NH3)4CO3 + H2O,类似的也可以生成[Cu(NH3)4] 2+、 [Pb(NH3)4]2+这样的络合离子,这些络合离子中的金属元素同样可以被置换出来,同时锰元素会随着金属锌一起进入浸出液中。
材料3:相关阳离子的氢氧化物的Ksp数据如表所示(室温):
阳离子 | Fe2+ | Mn2+ | Pb2+ | Fe3+ | Mn4+ | Pb4+ |
Ksp | 8.0×10-16 | 4.0×10-14 | 1.2×10-15 | 4.0×10-38 | 1.9×10-13 | 3.2×10-66 |
材料4:可选氧化剂与还原剂:
编号 | A | B | C | D |
氧化剂 | 氯气 | 35%过氧化氢 | 过氧化钠 | 酸性高锰酸钾溶液 |
还原剂 | 镁粉 | 铝粉 | 碳粉 | 锌粉 |
材料5:基本工艺(部分):
(1)加入氧化剂最好应选择材料4中的_______(填编号);后又加入还原剂的目的是还原溶液中的[Cu(NH3)4]2+、[Pb(NH3)4]2+等离子,请在材料4中选择合适的还原剂写出其中一个离子方程式_______.
(2)对滤液D的蒸发在工艺流程上也叫“蒸氨”,此过程中得到一种碱式盐沉淀物和两种气体,产生的气体可以在经过碱石灰处理后得到纯净而干燥的氨气。固体E经洗涤干燥后,灼烧得到产品,并产生水和CO2。则“蒸氨”过程中发生的化学反应方程式可表述为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿斯巴甜(Aspartame,结构简式如图)具有清爽的甜味,甜度约为蔗糖的200倍.下列关于阿斯巴甜的错误说法是
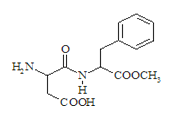
A.在一定条件下能发生取代反应、加成反应
B.酸性条件下的水解产物中有两种氨基酸
C.一定条件下既能与酸反应、又能与碱反应
D.分子式为C14H18N2O3,属于蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应:xA(g) +yB(g)![]() z C(g),平衡时测得A的浓度为0.50 mol/L,保持温度不变,将容器的容积扩大到原来的两倍。再达平衡时,测得A的浓度为0.30 mol/L。下列有关判断正确的是( )
z C(g),平衡时测得A的浓度为0.50 mol/L,保持温度不变,将容器的容积扩大到原来的两倍。再达平衡时,测得A的浓度为0.30 mol/L。下列有关判断正确的是( )
A.x+y < zB.平衡向正反应方向移动
C.C的体积分数下降D.B的转化率升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下:HCO3-+H2O![]() H2CO3+OH- Kh=2.2×10-8
H2CO3+OH- Kh=2.2×10-8
NH3·H2O![]() NH4++OH- Kb=1.8×10-5
NH4++OH- Kb=1.8×10-5
将NH4HCO3溶液和氨水按一定比例混合,可用于浸取矿渣中ZnO。若溶液混合引起的体积变化可忽略。
(1) 0.2 mol·L-1氨水中,c(NH4+)、c(OH-)、c(NH3·H2O)、c(H+)按从大到小的顺序排列为________;常温下,0.2 mol·L-1NH4HCO3溶液 pH________7 (选填“>”、“〈”或“=”)。
(2) 0. 2 mol·L-1 氨水和 0. 2 mol·L-1 NH4HCO3 溶液等体积混合后(NH3 按 NH3·H2O算),c(NH4+)+c(NH3·H2O)=______mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)苯和溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑。
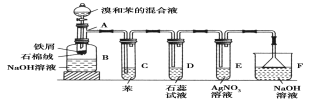
请填写下列空白:
①试管C中苯的作用是:______________________。
反应开始后,观察D和E两试管,看到的现象为:___________________。
②反应2~3min后,在B中的NaOH溶液里可观察到的现象是______________。
③在上述整套装置中,具有防倒吸的仪器有________(填字母)。
(2)实验室制备硝基苯的主要步骤如下:
a.配制一定比例的浓H2SO4与浓HNO3的混合酸,加入反应器中;
b.向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀;
c.在55℃~60℃下发生反应,直至反应结束;
d.除去混合酸后,粗产品依次用蒸馏水和5% NaOH溶液洗涤,最后再用蒸馏水洗涤;
e.将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯净硝基苯。
请填写下列空白:
①配制一定比例的浓H2SO4和浓HNO3的混合酸时,操作的注意事项是________。
②步骤d中洗涤、分离粗硝基苯应使用的仪器是________________。
③步骤d中粗产品用5% NaOH溶液洗涤的目的是___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com