
【题目】(1)苯和溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑。
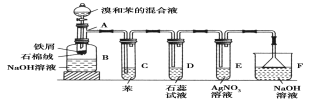
请填写下列空白:
①试管C中苯的作用是:______________________。
反应开始后,观察D和E两试管,看到的现象为:___________________。
②反应2~3min后,在B中的NaOH溶液里可观察到的现象是______________。
③在上述整套装置中,具有防倒吸的仪器有________(填字母)。
(2)实验室制备硝基苯的主要步骤如下:
a.配制一定比例的浓H2SO4与浓HNO3的混合酸,加入反应器中;
b.向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀;
c.在55℃~60℃下发生反应,直至反应结束;
d.除去混合酸后,粗产品依次用蒸馏水和5% NaOH溶液洗涤,最后再用蒸馏水洗涤;
e.将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯净硝基苯。
请填写下列空白:
①配制一定比例的浓H2SO4和浓HNO3的混合酸时,操作的注意事项是________。
②步骤d中洗涤、分离粗硝基苯应使用的仪器是________________。
③步骤d中粗产品用5% NaOH溶液洗涤的目的是___________________。
【答案】除去HBr气体中混有的溴蒸气 D试管中紫色石蕊试液慢慢变红,并在导管口有白雾产生,然后E试管中出现浅黄色沉淀 在溶液底部有无色油状液体 DEF 先将浓HNO3注入容器中,再慢慢注入浓H2SO4,并及时搅拌 分液漏斗 除去粗产品中残留的酸
【解析】
苯与溴单质在FeBr3作用下发生取代反应产生溴苯和HBr,反应产生的溴苯及未反应的溴单质进入盛有NaOH溶液的B装置中,Br2与NaOH溶液反应产生可溶于水的物质,溴苯不反应,密度比水大,因此B中液体分层,下层为溴苯;溴苯中的溴易挥发,易溶于苯,而HBr不溶于苯,经导气管进入D装置,HBr水溶液显酸性,可以使紫色石蕊试液变为红色,与AgNO3溶液反应产生AgBr浅黄色沉淀,HBr极容易溶于水,为防止倒吸现象,用倒扣的漏斗吸收HBr。
(1)①溴苯中的单质溴易挥发,溴和四氯化碳都是由非极性分子构成的物质,根据相似相溶原理知,溴易溶于四氯化碳,所以四氯化碳的作用是吸收HBr气体中的溴蒸汽;该反应中有溴化氢生成,溴化氢溶于水得到氢溴酸,氢溴酸是酸性物质,能使石蕊试液变红色,在试管口有白雾;氢溴酸能和硝酸银反应生成淡黄色沉淀溴化银,所以观察D和E两试管,看到的现象是D管中溶液变为红色,E管中出现浅黄色沉淀;
②溴苯是有机物,氢氧化钠溶液是无机物,所以溴苯和氢氧化钠溶液不互溶,且溴苯的密度大于水的密度,所以在B中的氢氧化钠溶液里可观察到的现象是液体分层,在下层出现油状液体;
③只要是导气管在液面上,不能接触液体,就可以防止发生倒吸现象,对装置图进行分析,可知在上述整套装置中,具有防倒吸的仪器有DEF;
(2)①浓硫酸与浓硝酸混合放出大量的热,配制混酸操作注意事项是:先将浓硝酸注入容器中,再慢慢注入浓硫酸,并及时搅拌和冷却,
②硝基苯是油状液体,与水不互溶,浓硝酸、浓硫酸易溶于水,所以步骤d中洗涤、分离粗硝基苯应使用的仪器是分液漏斗;
③反应得到粗产品中有残留的硝酸及硫酸,用5%的氢氧化钠溶液洗涤的目的是除去粗产品中残留的酸。


科目:高中化学 来源: 题型:
【题目】用多孔石墨电极完成下列实验:
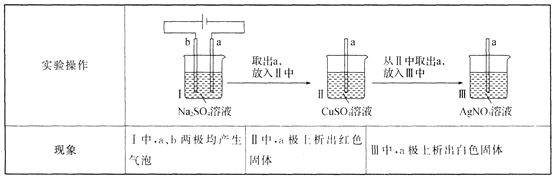
下列对实验现象的解释或推测不合理的是 ( )
A.I中,b极反应:2H2O-4e-=== O2↑+4 H+
B.Ⅱ中,析出红色固体:Cu2++H2 === Cu+2H+
C.Ⅲ中,只可能发生反应:2Ag++Cu === Cu2++2Ag
D.I中,a极上既发生了化学过程,也发生了物理过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】农业对化肥的需求是合成氨工业发展的持久推动力。
(1)氮原子最外电子层上有________种能量不同的电子,其原子核外存在________对自旋相反的电子。
(2)一定温度、压强下,氮气和氢气反应生成1mol氨气的过程中能量变化示意图如右,请写出该反应的热化学反应方程式:_____________。(Q的数值用含字母a、b的代数式表示)
下图表示500℃、60.0MPa条件下,原料气H2和N2的投料比与平衡时NH3体积分数的关系。
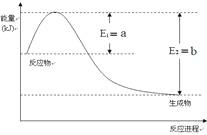
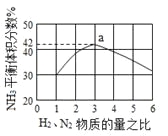
(3)工业上合成氨的温度一般控制在500℃,原因是____________________。
根据图中a点数据计算N2的平衡体积分数为__________。
(4)硫化铵晶体与晶体硅相比较,____________的熔点较高,原因是___________。
(5)写出等物质的量浓度等体积的硫酸氢钠与硫化铵溶液反应的离子方程________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—物质结构与性质】如右图是元素周期表的一部分。已知R的核电荷数小于36,气态氢化物沸点:MHn>YHn。
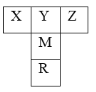
(1)表中五种元素第一电离能最大的是 (填元素符号),Y的最简单氢化物分子的空间构型为 ,基态R原子中有 个未成对电子。
(2)Y的最高价氧化物熔点比M的最高价氧化物熔点低,原因是 ,YZ-中σ键与π键的个数比为 。
(3)YO32-中Y原子的杂化方式是 ,写出一种与YO32-互为等电子体的粒子 (用化学符号表示)。
(4)Z的一种常见氢化物能与硫酸铜反应生成配合物。请用结构简式表示该配合物中的阳离子: 。
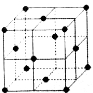
(5)如图为某金属单质的面心立方晶胞结构示意图,该晶体中配位数是 ;测得此晶体的密度为2.7g.cm-3,晶胞的边长为0.405nm,则此金属原子的相对原子质量为 (结果保留整数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是( )
A.苯佐卡因(![]() )是局部麻醉药,分子中含有2种官能团,分子式为C9H10NO2
)是局部麻醉药,分子中含有2种官能团,分子式为C9H10NO2
B.香叶醇(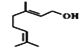 )能发生加成反应不能发生取代反应
)能发生加成反应不能发生取代反应
C.某有机物的分子式为C4H8,能使溴的CCl4溶液褪色,则它在一定条件下与水反应时最多可生成的有机物(不考虑立体异构)有4种
D.青蒿素(![]() )的一氯代物有5种(不含立体异构)
)的一氯代物有5种(不含立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有M、N、P、E、F五种金属,已知:①![]() ;②M、P用导线连接并放入硫酸氢钠溶液中,M表面有大量气泡逸出;③N、E用导线连接并放入E的硫酸盐溶液中,其中一极的电极反应式为
;②M、P用导线连接并放入硫酸氢钠溶液中,M表面有大量气泡逸出;③N、E用导线连接并放入E的硫酸盐溶液中,其中一极的电极反应式为![]() ;④P、F组成原电池时,F发生氧化反应。则这五种金属的还原性顺序是( )
;④P、F组成原电池时,F发生氧化反应。则这五种金属的还原性顺序是( )
A.F>P>M>N>EB.E>N>M>P>F
C.P>F>N>M>ED.E>P>F>M>N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:

回答下列问题:
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3![]() Na2CrO4+ Fe2O3+CO2+ NaNO2
Na2CrO4+ Fe2O3+CO2+ NaNO2
上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是________________。
(2)滤渣1中含量最多的金属元素是____________,滤渣2的主要成分是_____________及含硅杂质。
(3)步骤④调滤液2的pH使之变____________(填“大”或“小”),原因是___________________(用离子方程式表示)。
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到___________(填标号)得到的K2Cr2O7固体产品最多。

a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是___________________。
(5)某工厂用m1 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品 m2 kg,产率为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组对教材中乙醇氧化及产物检验的实验进行了改进和创新,其改进实验装置如图所示,按图组装好仪器,装好试剂。下列有关改进实验的叙述不正确的是
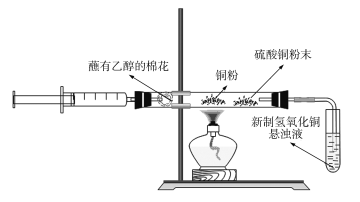
A.点燃酒精灯,轻轻推动注射器活塞即可实现乙醇氧化及部分产物的检验
B.铜粉黑红变化有关反应为:2Cu+O2![]() 2CuO、C2H5OH+CuO
2CuO、C2H5OH+CuO![]() CH3CHO+Cu+H2O
CH3CHO+Cu+H2O
C.硫酸铜粉末变蓝,说明乙醇氧化反应生成了水
D.在盛有新制氢氧化铜悬浊液的试管中能看到砖红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合溶液中可能含有下列离子中的若干种:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,现取三份20mL该溶液进行如下实验:
,现取三份20mL该溶液进行如下实验:
![]() 第一份加入足量盐酸,无任何气体产生
第一份加入足量盐酸,无任何气体产生
![]() 第二份加入足量NaOH溶液,经搅拌、过滤、洗涤、灼烧,最后得到xg固体
第二份加入足量NaOH溶液,经搅拌、过滤、洗涤、灼烧,最后得到xg固体
![]() 第三份滴加
第三份滴加![]() 酸性
酸性![]() 溶液,恰好完全反应,消耗其体积为VmL
溶液,恰好完全反应,消耗其体积为VmL
![]() 另用洁净的铂丝蘸取该混合溶液置于浅色火焰上灼烧,发现火焰呈现黄色
另用洁净的铂丝蘸取该混合溶液置于浅色火焰上灼烧,发现火焰呈现黄色
根据上述实验,以下说法正确的是![]()
A.由实验![]() 、
、![]() 可判定原混合溶液中是否存在
可判定原混合溶液中是否存在![]()
B.由实验![]() 可推断原混合溶液中是否含有
可推断原混合溶液中是否含有![]()
C.由实验![]() 可判定原混合溶液中是否含有
可判定原混合溶液中是否含有![]()
D.原混合溶液中只存在![]() 、
、![]() 、
、![]() ,不可能存在
,不可能存在![]() 、
、![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com