
ЁОЬтФПЁПЕЊЛЏЙшЃЈSi3N4ЃЉЪЧвЛжжживЊЕФЬеДЩВФСЯЃЌПЩгУЪЏгЂгыНЙЬПдк1400~1450ЁцЕФЕЊЦјЦјЗеЯТКЯГЩЃК3SiO2(s)+6C(s)+2N2(g)![]() Si3N4(s)+6CO(g)-Q(Q>0)ЁЃдквЛЖЈЬѕМўЯТЃЌЯђ10LУмБеШнЦїжаМгШыЗДгІЮяЃЌ10minКѓДяЕНЦНКтЁЃ
Si3N4(s)+6CO(g)-Q(Q>0)ЁЃдквЛЖЈЬѕМўЯТЃЌЯђ10LУмБеШнЦїжаМгШыЗДгІЮяЃЌ10minКѓДяЕНЦНКтЁЃ
ЭъГЩЯТСаЬюПеЃК
ЃЈ1ЃЉЩЯЪіЗДгІЫљЩцМАЕФдЊЫиЃЌдзгАыОЖгЩДѓЕНаЁЕФЫГађЪЧ_____ЁЃЦфжавЛжждЊЫиЕФдзгКЫЭтsЕчзгЪ§гыpЕчзгЪ§ЯрЕШЃЌаДГіЫќЕФКЫЭтЕчзгХХВМЪН______ЁЃ
ЃЈ2ЃЉЩЯЪіЗДгІЛьКЯЮяжаЕФМЋадЗжзгЪЧ______ЃЌаДГіЗЧМЋадЗжзгЕФЕчзгЪН______ЁЃЗжЮігУЕЊЛЏЙшжЦдьжсГаКЭЗЂЖЏЛњжаФЭШШВПМўЕФдвђЪЧЃК______ЁЃ
ЃЈ3ЃЉЯТСаДыЪЉПЩвдЬсИпЖўбѕЛЏЙшзЊЛЏТЪЕФЪЧ______ЃЈбЁЬюБрКХЃЉЁЃ
a.діМгНЙЬПгУСП b.Щ§ИпЗДгІЮТЖШ
c.діДѓЦјЬхбЙЧП d.ЯђЗДгІШнЦїжаЖрГфШыЕЊЦј
ЃЈ4ЃЉЯТСаУшЪіжаФмЫЕУїЗДгІвбДяЦНКтЕФЪЧ______ЃЈбЁЬюБрКХЃЉЁЃ
a.c(CO)=3c(N2) b.v(CO)=3v(N2)
c.ШнЦїФкЦјЬхЕФУмЖШВЛБф d.ЦјЬхЕФбЙЧПБЃГжВЛБф
ЃЈ5ЃЉИУЗДгІЕФЦНКтГЃЪ§ЮЊ____ЃЌЦНКтКѓдіМгЕЊЦјХЈЖШЃЌЦНКтЯђ______ЃЈЬюЁАе§ЗДгІЁБЛђЁАФцЗДгІЁБЃЉЗНЯђвЦЖЏЃЌKжЕ____ЃЈЬюЁАБфДѓЁБЁАБфаЁЁБЛђЁАВЛБфЁБЃЉЁЃШєВтЕУЦНКтЪБЦјЬхжЪСПдіМгСЫ11.2gЃЌдђгУЕЊЦјБэЪОЕФЦНОљЗДгІЫйТЪЮЊ_____ЁЃ
ЁОД№АИЁПSiЃОCЃОNЃОO 1s22s22p4 CO ![]() ЕЊЛЏЙшЪЧдзгОЇЬхЃЌШлЕуИп bd cd
ЕЊЛЏЙшЪЧдзгОЇЬхЃЌШлЕуИп bd cd ![]() е§ЗДгІ ВЛБф 0.002molL-1min-1
е§ЗДгІ ВЛБф 0.002molL-1min-1
ЁОНтЮіЁП
ЃЈ1ЃЉЭЌжмЦкздзѓЖјгвдзгАыОЖМѕаЁЃЌЭЌжїзхздЩЯЖјЯТдзгАыОЖдіДѓЃЛ
ЩЯЪідЊЫижаЕФвЛжждЊЫиЕФдзгКЫЭтsЕчзгЪ§гыpЕчзгЪ§ЯрЕШЃЌКЫЭтЕчзгЪ§ХХВМЃК1s22s22p4ЃЛ
ЃЈ2ЃЉCOЪєгкМЋадЗжзгЃЌЕЊЦјЮЊЗЧМЋадЗжзгЃЌЕЊЦјЗжзгжаNдзгжЎМфаЮГЩ3ЖдЙВгУЕчзгЖдЃЛЕЊЛЏЙшЪЧдзгОЇЬхЁЂШлЕуИпЃЛ
ЃЈ3ЃЉЬсИпЖўбѕЛЏЙшзЊЛЏТЪЃЌгІИФБфЬѕМўЪЙЦНКте§ЯђвЦЖЏЃЌНсКЯЦНКтвЦЖЏЕУгАЯьвђЫиЗжЮіНтД№ЃЛ
ЃЈ4ЃЉПЩФцЗДгІЕНДяЦНКтЪБЃЌЭЌжжЮяжЪЕФе§ФцЫйТЪЯрЕШЧвБЃГжВЛБфЃЌИїзщЗжЕФХЈЖШЁЂКЌСПБЃГжВЛБфЃЌгЩДЫбмЩњЕФЦфЫќвЛаЉСПВЛБфЃЌХаЖЯЦНКтЕФЮяРэСПгІЫцЗДгІНјааЗЂЩњБфЛЏЃЌИУЮяРэСПгЩБфЛЏЕНВЛдйБфЛЏЫЕУїЕНДяЦНКтЃЛ
ЃЈ5ЃЉРћгУВюСПЗЈМЦЫуЩњГЩВЮМгЗДгІЕЊЦјЕФжЪСПЃЌдйИљОн![]() НјааМЦЫуЃЛ
НјааМЦЫуЃЛ
(1)ЭЌжмЦкздзѓЖјгвдзгАыОЖМѕаЁЃЌЭЌжїзхздЩЯЖјЯТдзгАыОЖдіДѓЃЌЙЪдзгАыОЖЃКSi>C>N>OЃЛ
ЩЯЪідЊЫижаЕФвЛжждЊЫиЕФдзгКЫЭтsЕчзгЪ§гыpЕчзгЪ§ЯрЕШЃЌКЫЭтЕчзгЪ§ХХВМЮЊ1s22s22p4ЃЛ
(2)COЪєгкМЋадЗжзгЃЛЕЊЦјЮЊЗЧН№ЪєадЗжзгЃЌЕЊЦјЗжзгжаNдзгжЎМфаЮГЩ3ЖдЙВгУЕчзгЖд,ЕчзгЪНЮЊ![]() ЃЛЕЊЛЏЙшЪЧдзгОЇЬхЁЂШлЕуИпЃЌПЩвджЦдьЗЂЖЏЛњжаФЭШШВПМўЃЛ
ЃЛЕЊЛЏЙшЪЧдзгОЇЬхЁЂШлЕуИпЃЌПЩвджЦдьЗЂЖЏЛњжаФЭШШВПМўЃЛ
(3)aЃЎНЙЬПЮЊЙЬЬхЃЌдіМгНЙЬПгУСПЃЌЦНКтВЛвЦЖЏЃЌaДэЮѓЃЛ
bЃЎе§ЗДгІЮЊЮќШШЗДгІЃЌЩ§ИпЗДгІЮТЖШЦНКте§ЯђвЦЖЏЃЌЖўбѕЛЏЙшзЊЛЏТЪдіДѓЃЌbе§ШЗЃЛ
cЃЎе§ЗДгІЮЊЦјЬхЬхЛ§діДѓЕФЗДгІЃЌдіДѓЦјЬхбЙЧПЃЌЦНКтФцЯђвЦЖЏЃЌЖўбѕЛЏЙшзЊЛЏТЪМѕаЁЃЌcДэЮѓЃЛ
dЃЎЯђЗДгІШнЦїжаЖрГфШыЗДгІЮяЕЊЦјЃЌЦНКте§ЯђвЦЖЏЃЌЖўбѕЛЏЙшзЊЛЏТЪдіДѓЃЌdе§ШЗЃЛ
Д№АИЮЊЃКbdЃЛ
(4)aЃЎЦНКтЪБCOЁЂЕЊЦјЕФХЈЖШжЎБШВЛвЛЖЈЕШгкЛЏбЇМЦСПЪ§жЎБШЃЌaДэЮѓЃЛ
bЃЎ![]() ЃЌЮДжИУїе§ФцЫйТЪЃЌШєОљЮЊе§ЗДгІЫйТЪЃЌЗДгІЪМжеАДИУБШР§ЙиЯЕНјааЃЌВЛФмХаЖЯЦНКтзДЬЌЃЌЕЋЗжБ№БэЪОе§ФцЫйТЪЪБЃЌПЩХаЖЯЗДгІЕНДяЦНКтЃЌbДэЮѓЃЛ
ЃЌЮДжИУїе§ФцЫйТЪЃЌШєОљЮЊе§ЗДгІЫйТЪЃЌЗДгІЪМжеАДИУБШР§ЙиЯЕНјааЃЌВЛФмХаЖЯЦНКтзДЬЌЃЌЕЋЗжБ№БэЪОе§ФцЫйТЪЪБЃЌПЩХаЖЯЗДгІЕНДяЦНКтЃЌbДэЮѓЃЛ
cЃЎИљОн![]() ЃЌдкЗДгІЕУЙ§ГЬжаЦјЬхжЪСПВЛЖЯдіМгЃЌЬхЛ§ВЛБфЃЌЫљвдУмЖШВЛЖЯдіДѓЃЌЕЋЪЧЕБЦНКтЪБЃЌЦјЬхжЪСПВЛБфЃЌУмЖШвВВЛБфЃЌЫљвдПЩХаЖЯЦНКтзДЬЌЃЌcе§ШЗЃЛ
ЃЌдкЗДгІЕУЙ§ГЬжаЦјЬхжЪСПВЛЖЯдіМгЃЌЬхЛ§ВЛБфЃЌЫљвдУмЖШВЛЖЯдіДѓЃЌЕЋЪЧЕБЦНКтЪБЃЌЦјЬхжЪСПВЛБфЃЌУмЖШвВВЛБфЃЌЫљвдПЩХаЖЯЦНКтзДЬЌЃЌcе§ШЗЃЛ
dЃЎЫцЗДгІНјааЦјЬхЮяжЪЕФСПдіДѓЃЌКуЮТКуШнЯТбЙЧПдіДѓЃЌЦјЬхЕФбЙЧПБЃГжВЛБфЃЌЫЕУїЗДгІЕНДяЦНКтЃЌdе§ШЗЃЛ
Д№АИЮЊЃКcdЃЛ
(5)ЦНКтГЃЪ§БэДяЪНЃК![]() ЃЛдіДѓЗДгІЮяЕЊЦјХЈЖШЪБЃЌЦНКтЯђе§ЯђвЦЖЏЃЛЕЋЪЧгЩгкЮТЖШУЛгаБфЛЏЃЌЫљвдЦНКтГЃЪ§ДѓаЁВЛБфЃЛ
ЃЛдіДѓЗДгІЮяЕЊЦјХЈЖШЪБЃЌЦНКтЯђе§ЯђвЦЖЏЃЛЕЋЪЧгЩгкЮТЖШУЛгаБфЛЏЃЌЫљвдЦНКтГЃЪ§ДѓаЁВЛБфЃЛ
РћгУВюСПЗЈЃЌЩшВЮМгЗДгІЕФN2жЪСПЮЊxЃК
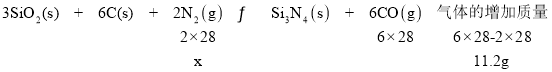
НтЕУ![]() ЃЌдђ
ЃЌдђ![]() ЃЌПЩЫуЃК
ЃЌПЩЫуЃК![]() ЁЃ
ЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПОлѕЃАЗ-66ЪЧКЌгаыФМќЕФИпЗжзгЛЏКЯЮяЃЌГЃгУгкЩњВњеЪХёЁЂгцЭјЕШЁЃПЩгУвдЯТЗНЗЈКЯГЩЃК
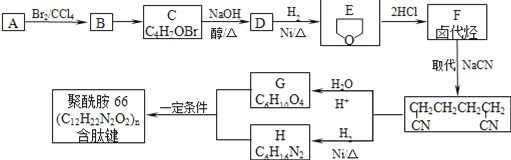
вбжЊЃКAгыEЛЅЮЊЭЌЗжвьЙЙЬхЃЌЭъГЩЯТСаЬюПеЃК
(1)AЁњBЕФЗДгІРраЭ______ЃЌAжаКЌбѕЙйФмЭХЕФУћГЦ______
(2)BЕФНсЙЙМђЪН______ЃЌDПЩФмЕФНсЙЙМђЪН______
(3)FгыЧтбѕЛЏФЦЕФввДМШмвКЙВШШЕУЕНЬўIЃЌIЕФУћГЦ______ЁЃБШIЖрвЛИіЬМдзгЕФЭЌЯЕЮяЃЌгыЕШЮяжЪЕФСПфхЗДгІЩњГЩЖўфхДњЮяЕФНсЙЙМђЪНе§ШЗЕФЪЧ______
a.![]()
b.![]()
c.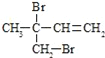
d.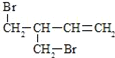
(4)GКЭHЗДгІЩњГЩОлѕЃАЗ-66ЕФЛЏбЇЗНГЬЪНЃК______
(5)ЭЌЪБТњзуЯТСаЬѕМўЕФGЕФЭЌЗжвьЙЙЬхЕФНсЙЙМђЪНЮЊ______
ЂйКЌвЛжжЙйФмЭХ ЂкФмЗЂЩњвјОЕЗДгІ ЂлКЌМзЛљЧвгаШ§жжЛЏбЇЛЗОГВЛЭЌЕФЧтдзг
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПВнЫсгыИпУЬЫсМидкЫсадЬѕМўЯТФмЙЛЗЂЩњШчЯТЗДгІЃКMnO4-+H2C2O4+H+-Mn2++CO2Ёќ+H2OЃЈЮДХфЦНЃЉ
ЂёЃЎМзЭЌбЇбаОПЭтНчвђЫиЖдЗДгІЫйТЪгАЯьЃЌЩшМЦШчЯТЪЕбщЗНАИЃК
гУ4mL0.001mol/LKMnO4ШмвКгы2mL0.01mol/LH2C2O4ШмвКЃЌбаОПВЛЭЌЬѕМўЖдЛЏбЇЗДгІЫйТЪЕФгАЯьЃЎИФБфЕФЬѕМўШчЯТЃК
зщБ№ | 10%СђЫсЬхЛ§/mL | ЮТЖШ/Ёц | ЦфЫћЮяжЪ |
A | 2mL | 20 | |
B | 2mL | 20 | 10ЕЮБЅКЭMnSO4ШмвК |
C | 2mL | 30 | |
D | 1mL | 20 | V1mLеєСѓЫЎ |
E | 0.5mL | 20 | V2mLеєСѓЫЎ |
ЃЈ1ЃЉЭъГЩЩЯЪіЪЕбщЗНАИЩшМЦЃЌЦфжаЃКV1= ______ ЃЌV2= ______ ЃЛ
ЃЈ2ЃЉШчЙћбаОПЮТЖШЖдЛЏбЇЗДгІЫйТЪЕФгАЯьЃЌЪЙгУЪЕбщ ______ КЭ ______ ЃЎ
ЃЈ3ЃЉМзЭЌбЇдкзіAзщЪЕбщЪБЃЌЗЂЯжЗДгІПЊЪМЪБЫйТЪНЯТ§ЃЌЫцКѓМгПьЃЎЫћЗжЮіШЯЮЊИпУЬЫсМигы ВнЫсШмвКЕФЗДгІЗХШШЃЌЕМжТШмвКЮТЖШЩ§ИпЃЌЗДгІЫйТЪМгПьЃЛДггАЯьЛЏбЇЗДгІЫйТЪЕФвђЫиПДЃЌФуВТЯыЛЙПЩФмЪЧ ______ ЃЛ
ЂђЃЎввЭЌбЇРћгУШчЭМВтЖЈЗДгІЫйТЪ

ЛиД№ЯТСаЮЪЬт
ЃЈ4ЃЉЪЕбщЪБвЊМьВщзАжУЕФЦјУмадЃЌМђЪіВйзїЕФЗНЗЈЪЧ ______ ЃЛ
ЃЈ5ЃЉввЭЌбЇЭЈЙ§ЩњГЩЯрЭЌЬхЛ§ЕФCO2РДБэЪОЗДгІЕФЫйТЪЃЌашвЊ ______ вЧРДМЧТМЪ§ОнЃЎ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвЛЖЈСПЕФFeЁЂFeOЁЂFe2O3ЁЂFe3O4ЕФЛьКЯЮяжаМгШы350mL 2molLЉ1ЕФЯЁЯѕЫсЧЁКУЪЙЛьКЯЮяЭъШЋШмНтЃЌЗХГі2.24L NOЃЈБъзМзДПіЃЉЃЌЭљЫљЕУШмвКжаМгШыKSCNШмвКЃЌЮоКьЩЋГіЯжЃЎШєгУзуСПЕФH2дкМгШШЬѕМўЯТЛЙдЯрЭЌжЪСПЕФЛьКЯЮяЃЌЫљЕУЕНЕФЬњЕФЮяжЪЕФСПЮЊЃЈ ЃЉ
A. 0.21 molB. 0.25 molC. 0.3 molD. 0.35 mol
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЕчНтЕЮгаЪЏШяЕФБЅКЭЪГбЮЫЎaЃЌвдЯТХаЖЯе§ШЗЕФЪЧЃЈ ЃЉ
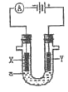
A.ЕчНтЪБЛЏбЇФмзЊБфЮЊЕчФм
B.YМЋИННќзюжеБфЮЊКьЩЋ
C.ЕчзгСїЯђЃКXЁњИКМЋЁње§МЋЁњY
D.ЕчНтвЛЖЮЪБМфСНМЋЪеМЏЕФЦјЬхЬхЛ§ЃКXМЋ>YМЋ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгУO2НЋHClзЊЛЏЮЊCl2ЃЌЗДгІЗНГЬЪНЮЊЃК4HCl(g) + O2(g)![]() 2H2O(g)+ 2Cl2(g)+QЃЈQ>0ЃЉвЛЖЈЬѕМўЯТВтЕУЗДгІЙ§ГЬжаn(Cl2)ЕФЪЕбщЪ§ОнШчЯТЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
2H2O(g)+ 2Cl2(g)+QЃЈQ>0ЃЉвЛЖЈЬѕМўЯТВтЕУЗДгІЙ§ГЬжаn(Cl2)ЕФЪЕбщЪ§ОнШчЯТЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
t/min | 0 | 2 | 4 | 6 |
n(Cl2)/10-3 mol | 0 | 1.8 | 3.7 | 5.4 |
A.0ЁЋ2 minЕФЗДгІЫйТЪаЁгк4ЁЋ6 minЕФЗДгІЫйТЪ
B.2ЁЋ6 minгУCl2БэЪОЕФЗДгІЫйТЪЮЊ0.9 mol/(LЁЄmin)
C.діДѓбЙЧППЩвдЬсИпHClзЊЛЏТЪ
D.ЦНКтГЃЪ§K(200Ёц)ЃМK(400Ёц)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП2015ФъЃЌЮвЙњПЦбЇМвЭРпЯпЯвђдкЧрняЫиЗЂЯжКЭжЮСЦжаЕФЙБЯзЃЌЛёЕУСЫХЕБДЖћЩњРэбЇЛђвНбЇНБЁЃгЩжВЮяЛЦЛЈнявЖжаЬсШЁЕФЧрняЫиЛЙПЩКЯГЩгУгкПЙТШрЖёадХБМАазЯеаЭХБМВЕФняМзУбЃЌЦфКЯГЩТЗЯпШчЯТЃК
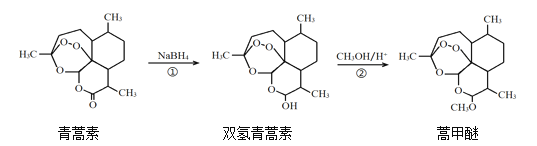
ЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
A.ЧрняЫиЕФЗжзгЪНЪЧC15H21O4
B.ЧрняЫидкNaOHШмвКжаПЩвдЗЂЩњЫЎНтЗДгІ
C.ЗДгІЂкгаH2OЩњГЩ
D.ЗДгІЂйбѕЛЏЗДгІ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПГЃЮТЯТЃЌФГШмвКжагЩЫЎЕчРыГіЕФc(H+)=l ЁС10-13 molЁЄL-1ЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧ
A.дкИУШмвКжавЛЖЈФмЭЌЪБДѓСПДцдкCu2+ЁЂNO3-ЁЂCl-ЁЂNa+ЕШРызг
B.дкИУШмвКжагаПЩФмЭЌЪБДѓСПДцдкK+ЁЂNO3-ЁЂHCO3-ЁЂNa+ЕШРызг
C.ИУШмвКЕФpHПЩФмЮЊ13ЃЌвВПЩФмЮЊ1
D.ИУШмвКжа c(OH-)=lЁС10-1 molЁЄL-1
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПбаОПЕЊбѕЛЏЮягыаќИЁдкДѓЦјжаКЃбЮСЃзгЕФЯрЛЅзїгУЪБЃЌЗЂЩњШчЯТЗДгІЃК4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g)
ЭъГЩЯТСаЬюПеЃК
(1)аДГіИУЗДгІЕФЦНКтГЃЪ§БэДяЪНK=______ЁЃШєжЛИФБфвЛИігАЯьЛЏбЇЦНКтЕФвђЫиЃЌдђЯТСаЙигкЦНКтГЃЪ§KгыЛЏбЇЦНКтвЦЖЏЙиЯЕЕФа№Ъіе§ШЗЕФЪЧ______(ЬюађКХ)ЁЃ
aЃЎKжЕВЛБфЃЌЦНКтВЛвЦЖЏ
bЃЎKжЕБфЛЏЃЌЦНКтвЛЖЈвЦЖЏ
cЃЎЦНКтвЦЖЏЃЌKжЕПЩФмВЛБф
dЃЎЦНКтвЦЖЏЃЌKжЕвЛЖЈБфЛЏ
(2)ШєЗДгІдкКуШнУмБеШнЦїжаНјааЃЌФмЫЕУїИУЗДгІвбДяЕНЦНКтзДЬЌЕФЪЧ_____(ЬюађКХ)ЁЃ
aЃЎІде§(NO2)=2Іде§(NO)
bЃЎNOКЭCl2ЕФЮяжЪЕФСПжЎБШВЛБф
cЃЎЛьКЯЦјЬхУмЖШБЃГжВЛБф
dЃЎc (NO2)ЃКc (NO)ЃКc (Cl2)=4ЃК2ЃК1
(3)ЮЊбаОПВЛЭЌЬѕМўЖдЗДгІЕФгАЯьЃЌдкКуЮТЬѕМўЯТЃЌЯђ2LКуШнУмБеШнЦїжаМгШы0.4mol NO2КЭЪЪСПNaClЙЬЬхЃЌ10minЪБЗДгІДяЕНЦНКтЃЎВтЕУ10minФкІд(NO2)=0.015mol/(Lmin)ЃЌдђЦНКтКѓn (Cl2)=______molЃЌДЫЪБNO2ЕФзЊЛЏТЪЮЊЇб1ЃЛБЃГжЦфЫќЬѕМўВЛБфЃЌРЉДѓШнЦїЕФЬхЛ§ЃЌЕБЗДгІдйДЮДяЕНЦНКтЪБNO2ЕФзЊЛЏТЪЮЊЇб2ЃЌдђЇб2_____Їб1(бЁЬюЁАЃОЁБЁЂЁАЃМЁБЛђЁА=ЁБ)ЁЃ
ЪЕбщЪвПЩгУNaOHШмвКЮќЪеNO2ЃЌЗДгІЮЊ2NO2+2NaOHЁњNaNO3+NaNO2+H2OЃЎКЌ0.2mol NaOHЕФЫЎШмвКгы0.2mol NO2ЧЁКУЭъШЋЗДгІЕУЕН1LШмвКAЃЌШмвКBЮЊ0.1mol/LЕФCH3COONaШмвКЁЃ
(4)СНШмвКжаc(NO3Љ)ЁЂc(NO2Љ)КЭc(CH3COOЉ)гЩДѓЕНаЁЕФЫГађЮЊ________________ЁЃ
(5)ПЩЪЙШмвКAКЭШмвКBЕФpHЯрЕШЕФЗНЗЈЪЧ__________(ЬюађКХ)ЁЃ
aЃЎЯђШмвКAжаМгЪЪСПЫЎ
bЃЎЯђШмвКAжаМгЪЪСПNaOH
cЃЎЯђШмвКBжаМгЪЪСПЫЎ
dЃЎЯђШмвКBжаМгЪЪСПNaOH
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com