
【题目】电解滴有石蕊的饱和食盐水a,以下判断正确的是( )
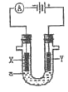
A.电解时化学能转变为电能
B.Y极附近最终变为红色
C.电子流向:X→负极→正极→Y
D.电解一段时间两极收集的气体体积:X极>Y极
【答案】D
【解析】
此装置使电解饱和食盐水,是将电能转化为化学能的装置,Y连接电源正极,Y是阳极:Cl-失去电子变成Cl2,X连接电池的负极,X是阴极:H+得到电子变成氢气,且生成OH-;
A.电解池装置是将电能转化为化学能的装置,A错误;
B. Y电极:![]() ,因为滴加的是石蕊溶液,故溶液颜色不会变红,B错误;
,因为滴加的是石蕊溶液,故溶液颜色不会变红,B错误;
C.电子的流通路径只能在导线中,电解质溶液和电池的内部是不出现电子的,所以电子的流向分两段,一段是负极→阴极,一段是阳极→正极,C错误;
D.电解的过程中阳极分两个阶段产生气体,第一阶段是:![]() ,第二阶段是:
,第二阶段是:![]() ,阴极只发生:
,阴极只发生:![]() ,根据电极方程式可得,第一阶段中理论阳极(Y)产生的Cl2和阴极(X)产生的H2相等,而且氯气会溶解于水中一部分,故Y收集的气体比X收集的较少;第二阶段阳极(Y)产生的O2比阴极(X)H2少,综合可得,电解一段时间两极收集的气体体积:X极>Y极,D正确;
,根据电极方程式可得,第一阶段中理论阳极(Y)产生的Cl2和阴极(X)产生的H2相等,而且氯气会溶解于水中一部分,故Y收集的气体比X收集的较少;第二阶段阳极(Y)产生的O2比阴极(X)H2少,综合可得,电解一段时间两极收集的气体体积:X极>Y极,D正确;
答案选D。


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】氮化硅(Si3N4)是一种重要的陶瓷材料,可用石英与焦炭在1400~1450℃的氮气气氛下合成:3SiO2(s)+6C(s)+2N2(g)![]() Si3N4(s)+6CO(g)﹣Q(Q>0),在反应条件下,向10L密闭容器中加入反应物,10min后达到平衡。完成下列填空:
Si3N4(s)+6CO(g)﹣Q(Q>0),在反应条件下,向10L密闭容器中加入反应物,10min后达到平衡。完成下列填空:
(1)上述反应所涉及的元素,原子半径由大到小的顺序是______。其中一种元素的原子核外s电子数与p电子数相等,写出它的最外层电子排布的轨道表示式______。比较碳、硅两种元素的非金属性强弱,可以通过比较______(填:化合物性质的差异)来判断
(2)上述反应混合物中的极性分子是______,写出非极性分子的电子式______。从晶体类型的角度分析用氮化硅制造发动机中耐热部件的原因是______
(3)下列措施可以提高二氧化硅转化率的是______(选填编号)
a.增加二氧化硅用量b.升高反应温度
c.增大气体压强 d.向反应容器中多充入氮气
(4)下列描述中能说明反应已达平衡的是______(选填编号)
a.c(CO)=3c(N2)
b.v (CO)=3v(N2)
c.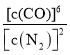 保持不变
保持不变
d.气体的压强保持不变
(5)测得平衡时固体质量减少了11.2g,则用氮气表示的平均反应速率为______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2010年诺贝尔化学奖获得者赫克、伊智根岸(美)和铃木彰(日)在钯催化交叉偶联反应方面的研究,为化学家提供了更为精确、有效的工具,极大促进了制造复杂化学物质的可能性。已知一种钯催化的交叉偶联反应可以表示为:
![]()
下面是利用钯催化的交叉偶联反应,以烃A与苯为原料合成某个复杂分子L(相对质量不超过200)的过程,其中F在浓硫酸作用下可以发生两种不同的反应分别形成H和G。
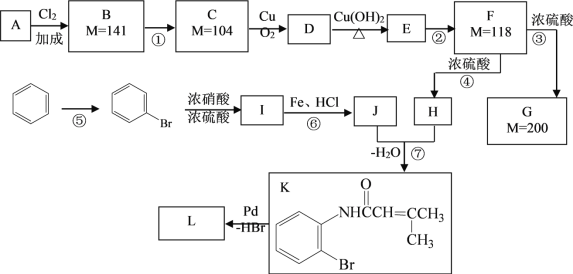
(1)写出反应的反应类型:④____________ ⑥________________ ;
(2)写出反应需要的无机反应物、反应条件:
①_______________,⑤_________________;
(3)根据要求完成下列两个空格:
用系统命名法给物质A命名:________________;
写出物质L的结构简式:__________________。
(4)写出下列反应的化学方程式:
C→D:_________________________;
F→G:_________________________。
(5)H有多种同分异构体,请写出一种符合下列条件的结构简式:_________。
i. 能发生水解反应 ii. 分子中只含有两个甲基 iii. 不含环状结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间的转化均能实现的是
A.NaCl(aq)![]() NaHCO3(s)
NaHCO3(s)![]() Na2CO3(s)
Na2CO3(s)
B.CuCl2(aq)![]() Cu(OH)2(s)
Cu(OH)2(s) ![]() Cu(s)
Cu(s)
C.MgCl26H2O(s) ![]() MgCl2(s)
MgCl2(s)![]() Mg(s)
Mg(s)
D.NH3(g)![]() NO(g)
NO(g)![]() HNO3(aq)
HNO3(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重要的化学品M和N的合成路线如图所示:

已知:i.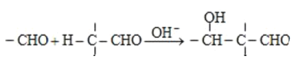
ii.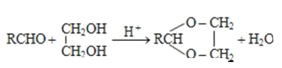
iiiN的结构简式是: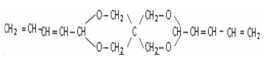
请回答下列问题:
(1)A中含氧官能团名称是______,C 与E生成M的反应类型是______.
(2)写出下列物质的结构简式:X:______ Z:______ E:______
(3)C和甲醇反应的产物可以发生聚合反应.该聚合反应的产物是:______.
(4)1mol G一定条件下,最多能与______mol H2发生反应
(5)写出一种符合下列要求G的同分异构体______
①有碳碳叄键 ②能发生银镜反应 ③一氯取代物只有2种
(6)1,3﹣丙二醇是重要的化工物质,请设计由乙醇合成它的流程图______,合成路线流程图示例如下:CH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH.
CH3CH2OH.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硅(Si3N4)是一种重要的陶瓷材料,可用石英与焦炭在1400~1450℃的氮气气氛下合成:3SiO2(s)+6C(s)+2N2(g)![]() Si3N4(s)+6CO(g)-Q(Q>0)。在一定条件下,向10L密闭容器中加入反应物,10min后达到平衡。
Si3N4(s)+6CO(g)-Q(Q>0)。在一定条件下,向10L密闭容器中加入反应物,10min后达到平衡。
完成下列填空:
(1)上述反应所涉及的元素,原子半径由大到小的顺序是_____。其中一种元素的原子核外s电子数与p电子数相等,写出它的核外电子排布式______。
(2)上述反应混合物中的极性分子是______,写出非极性分子的电子式______。分析用氮化硅制造轴承和发动机中耐热部件的原因是:______。
(3)下列措施可以提高二氧化硅转化率的是______(选填编号)。
a.增加焦炭用量 b.升高反应温度
c.增大气体压强 d.向反应容器中多充入氮气
(4)下列描述中能说明反应已达平衡的是______(选填编号)。
a.c(CO)=3c(N2) b.v(CO)=3v(N2)
c.容器内气体的密度不变 d.气体的压强保持不变
(5)该反应的平衡常数为____,平衡后增加氮气浓度,平衡向______(填“正反应”或“逆反应”)方向移动,K值____(填“变大”“变小”或“不变”)。若测得平衡时气体质量增加了11.2g,则用氮气表示的平均反应速率为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A(C3H6)是基本有机化工原料。由A制备聚合物C和![]() 的合成路线(部分反应条件略去)如图所示:
的合成路线(部分反应条件略去)如图所示:
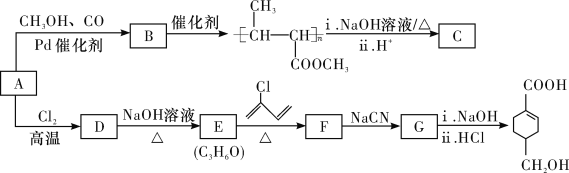
已知:
①![]() +
+![]()
![]()
![]()
②R—C≡N![]() R—COOH
R—COOH
回答下列问题:
(1)D的名称是___________,B含有的含氧官能团的名称是__________。
(2)C的结构简式为_____________,D→E的反应类型为 ____________。
(3)E→F的化学方程式为___________。
(4)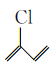 中最多有_____个原子共平面,
中最多有_____个原子共平面,![]() 发生缩聚反应生成有机物的结构简式为__________。
发生缩聚反应生成有机物的结构简式为__________。
(5)B的同分异构体中,与B具有相同的官能团且能发生银镜反应的共有_______种(不考虑立体异构);其中核磁共振氢谱为3组峰,且峰面积之比为6:1:1的是__________(写结构简式)。
(6)结合题给信息,以乙烯、HBr为起始原料制备丙酸,设计合成路线(其他试剂任选)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从含锌矿渣中提取制备锌白(ZnO)有多种方法,其中氨一碳酸氢铵法的优点是成本低。请根据以下材料,回答问题:
材料1:某矿渣的主要成份为ZnO、Fe2O3、PbO、MnO、CuO、SiO2。
材料2:主要反应原理:ZnO+NH4HCO3+3NH3=Zn(NH3)4CO3 + H2O,类似的也可以生成[Cu(NH3)4] 2+、 [Pb(NH3)4]2+这样的络合离子,这些络合离子中的金属元素同样可以被置换出来,同时锰元素会随着金属锌一起进入浸出液中。
材料3:相关阳离子的氢氧化物的Ksp数据如表所示(室温):
阳离子 | Fe2+ | Mn2+ | Pb2+ | Fe3+ | Mn4+ | Pb4+ |
Ksp | 8.0×10-16 | 4.0×10-14 | 1.2×10-15 | 4.0×10-38 | 1.9×10-13 | 3.2×10-66 |
材料4:可选氧化剂与还原剂:
编号 | A | B | C | D |
氧化剂 | 氯气 | 35%过氧化氢 | 过氧化钠 | 酸性高锰酸钾溶液 |
还原剂 | 镁粉 | 铝粉 | 碳粉 | 锌粉 |
材料5:基本工艺(部分):
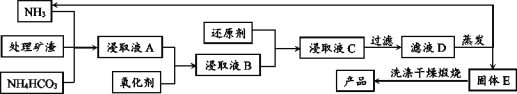
(1)加入氧化剂最好应选择材料4中的_______(填编号);后又加入还原剂的目的是还原溶液中的[Cu(NH3)4]2+、[Pb(NH3)4]2+等离子,请在材料4中选择合适的还原剂写出其中一个离子方程式_______.
(2)对滤液D的蒸发在工艺流程上也叫“蒸氨”,此过程中得到一种碱式盐沉淀物和两种气体,产生的气体可以在经过碱石灰处理后得到纯净而干燥的氨气。固体E经洗涤干燥后,灼烧得到产品,并产生水和CO2。则“蒸氨”过程中发生的化学反应方程式可表述为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.按系统命名法,化合物![]() 的名称是2,3,5,5-四甲基-4,4-二乙基己烷
的名称是2,3,5,5-四甲基-4,4-二乙基己烷
B.等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等
C.苯和甲苯互为同系物,均能使KMnO4酸性溶液褪色
D.结构片段 的高聚物,其单体是苯酚和甲醛
的高聚物,其单体是苯酚和甲醛
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com