NA表示阿伏加德罗常数的值.下列叙述正确的是( )
A.33.6L(常温常压)氯气与2.7g铝充分反应,转移电子数为0.3NA
B.标准状况下,22.4L乙烷含有共价键数目为8NA
C.由NA个CO和NA个N2组成的混合物中含有10NA个电子
D.1L lmol?L-1的Na2SO4溶液中含有4NA个离子
【答案】
分析:A、常温常压下33.6L氯气物质的量大于1,5mol,3Cl
2+2Al=2AlCl
3,反应定量关系分析氯气过量;
B、依据标准状况下气体物质的量n=

,结合乙烷分子结构计算共价键数;
C、N
A个CO为1mol含电子数14mol,N
A个N
2为1mol含电子数14mol,混合后含电子数28N
A;
D、n=Vc计算溶质物质的量为1mol,含离子为2molNa
+,1molSO
42-,含有3N
A个离子.
解答:解:A、常温常压下33.6L氯气物质的量大于1.5mol,3Cl
2+2Al=2AlCl
3,反应定量关系分析氯气过量,所以反应电子转移用2.7g铝计算得到,2.7g铝物质的量为0.1mol,反应失去的电子数为0.3mol,故A正确;
B、标准状况下乙烷气体物质的量n=
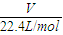
=1mol,1mol乙烷分子中含共价键数=1mol×(2-1+6)×NA/mol=7N
A,故B错误;
C、N
A个CO为1mol含电子数14mol,N
A个N
2为1mol含电子数14mol,混合后含电子数28N
A,故C错误;
D、n=Vc计算溶质物质的量为1mol,含离子为2molNa
+,1molSO
42-,含有3N
A个离子,故D错误;
故选A.
点评:本题考查了阿伏伽德罗常数的应用,主要是化学方程式的过量计算判断,氧化还原反应的电子转移计算,物质的量计算微粒数,题目难度中等.

 ,结合乙烷分子结构计算共价键数;
,结合乙烷分子结构计算共价键数;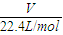 =1mol,1mol乙烷分子中含共价键数=1mol×(2-1+6)×NA/mol=7NA,故B错误;
=1mol,1mol乙烷分子中含共价键数=1mol×(2-1+6)×NA/mol=7NA,故B错误;
