

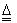 2CuO ;CuO+H2SO4=CuSO4+H2O
2CuO ;CuO+H2SO4=CuSO4+H2O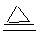 2CuSO4 + 2H2O
2CuSO4 + 2H2O

科目:高中化学 来源:不详 题型:单选题
| A.只有① | B.只有③ | C.②③④ | D.①②③④都正确 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 ,C ,D 。
,C ,D 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素 | 有关信息 |
| A | 最高价氧化物对应的水化物(甲)能与其气态氢化物(乙)反应生成盐 |
| B | 地壳中含量最高的元素,A与B可形成一种质量比为 7︰12的化合物(丙) |
| C | 单质曾用于焊接钢轨 |
| D | 单质是生活中常见金属,其制品在自然环境中被腐蚀呈现红棕色 |
 可能是____________________mL。
可能是____________________mL。 A2B4(g);△H<0。在恒温恒容条件下,将一定量AB2和A2B4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。
A2B4(g);△H<0。在恒温恒容条件下,将一定量AB2和A2B4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。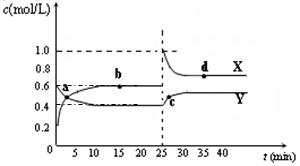
 ① a、b、c、d四个点中,化学反应处于平衡状态的是_______点。
① a、b、c、d四个点中,化学反应处于平衡状态的是_______点。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| J | | |
| | | R |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NaOH | B.Al2(SO4)3 | C.MgSO4 | D.BaCl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com