
【题目】下列离子方程式中,均属于水解反应的是( )
A. HCOOH+H2O![]() HCOO-+H3O+ H2O +H2O
HCOO-+H3O+ H2O +H2O![]() H3O++OH-
H3O++OH-
B. CO2+H2O![]() HCO3-+H+ AlO2-+HCO3-+H2O=Al (OH)3↓+CO32-
HCO3-+H+ AlO2-+HCO3-+H2O=Al (OH)3↓+CO32-
C. CO32-+H2O![]() HCO3-+OH- AlO2-+2H2O
HCO3-+OH- AlO2-+2H2O![]() Al (OH)3+OH-
Al (OH)3+OH-
D. HS-+H2O![]() S2-+H3O+ Fe3++3H2O
S2-+H3O+ Fe3++3H2O![]() Fe(OH)3+ 3H+
Fe(OH)3+ 3H+
【答案】C
【解析】
弱离子水解反应的实质是:弱离子和水电离出的氢离子或氢氧根离子结合生成弱电解质的过程,水解方程式用可逆号。
A、是甲酸和水的电离方程式,故A错误;
B、CO2+H2O![]() HCO3-+H+ 是碳酸的一级电离方程式,AlO2-+HCO3-+H2O=Al (OH)3↓+CO32-是复分解方程式,故B错误;
HCO3-+H+ 是碳酸的一级电离方程式,AlO2-+HCO3-+H2O=Al (OH)3↓+CO32-是复分解方程式,故B错误;
C、CO32-+H2O![]() HCO3-+OH- 是碳酸的水解方程式,AlO2-+HCO3-+H2O=Al (OH)3↓+CO32-是偏铝酸根的水解方程式,故C正确;
HCO3-+OH- 是碳酸的水解方程式,AlO2-+HCO3-+H2O=Al (OH)3↓+CO32-是偏铝酸根的水解方程式,故C正确;
D、HS-+H2O![]() S2-+H3O+ 是硫氢根离子的电离方程式,Fe3++3H2O
S2-+H3O+ 是硫氢根离子的电离方程式,Fe3++3H2O![]() Fe(OH)3+ 3H+是铁离子水解的方程式,故D错误;
Fe(OH)3+ 3H+是铁离子水解的方程式,故D错误;
故选C。


科目:高中化学 来源: 题型:
【题目】如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。下列说法正确的是

A. O2所在的铂电极处发生氧化反应
B. H+透过质子交换膜流向呼气所在的铂电极
C. 电路中流过2mol电子时,消耗标准状况下11.2LO2
D. 该电池的负极反应式为:CH3CH2OH+3H2O-12e-=2CO2+12H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组学习了亚铁盐的性质后,欲探究FeSO4溶液分别与Na2CO3溶液、NaHCO3溶液的反应。已知:Fe(OH)2和FeCO3均为白色沉淀,不存在Fe(HCO3)2。实验操作及现象记录如下:
实验 | 试剂 | 操作及现象 | ||
试管(I) | 试管(II) | |||
(试管容积为50 mL) | 实验a | 1.0 mol·L-1 FeSO4溶液 24 mL | 1.0 mol·L-1 Na2CO3溶液24mL | 倾倒完后,迅速用胶塞塞紧试管I的口部,反复上下颠倒摇匀,使反应物充分混合 反应过程中无气泡产生,生成白色絮状沉淀 放置1.5~2 h后,白色絮状沉淀转化为白色颗粒状沉淀 |
实验b | 1.0 mol·L-1 FeSO4溶液 10 mL | 1.0 mol·L-1 NaHCO3溶液 20 mL | 倾倒完后,迅速产生白色颗粒状沉淀和大量气泡。振荡,经2~4 min后液面上方试管内壁粘附的白色颗粒状沉淀物变成红褐色 | |
(1)甲同学认为实验a中白色颗粒状沉淀是FeCO3,写出该反应的离子方程式:________;他为了证实自己的观点,进行实验:取少量白色颗粒状沉淀,加入________,发现产生大量气泡。
(2)乙同学推测实验a的白色颗粒状沉淀中还可能含有Fe(OH)2,他将实验a中两种溶液体积均改成15 mL后再进行实验,证实了他的推测。能证明Fe(OH)2存在的实验现象是_________。
(3)实验b中白色颗粒状沉淀主要成分也为FeCO3,写出生成FeCO3的离子方程式:________。
(4)实验b中液面上方试管内壁粘附的白色颗粒状沉淀物变成红褐色,主要原因是潮湿的FeCO3被氧气氧化,写出该反应的化学方程式:__________。
(5)乙同学反思,实验a中含有Fe(OH)2,实验b中几乎不含有Fe(OH)2,对比分析出现差异的原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列图像的描述中,正确的是( )

A. 根据图①可判断正反应的ΔH<0
B. 根据图②,除去CuSO4溶液中的Fe3+,可加入CuO调节pH至3~5
C. 图③可表示压强(p)对反应2A(g)+2B(g) ![]() 3C(g)+D(s)的影响
3C(g)+D(s)的影响
D. 图④为水的电离平衡曲线图,若从A点到C点,可采用在水中加入适量NaOH固体的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】紫草宁(shikonin,见下图)是从生长在亚洲学名叫Lithospermum erythrorhizon的一种植物的根部提取出来的红色化合物。几个世纪以来用做民间药物,如今用于配制治疗跌打损伤的膏药。下列说法不正确的是( )
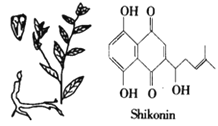
A. 紫草宁的分子式为C16H16O5
B. 等量的紫草宁与NaOH溶液、浓溴水反应,消耗NaOH、Br2 的物质的量之比为3:4
C. 紫草宁既能发生氧化反应又能发生还原反应
D. 常温下紫草宁不易溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据阿伏伽德罗常数回答下列问题
(1)在0.5mol CO2中含___个O原子,含___个e-。
(2)同温同压下,同质量的氨气和硫化氢气体体积比为____,其中含有的氢原子数目比为____。
(3)___mol H2SO4分子与1.806×1024个H2O分子含有相同的氧原子数?
(4)12.4g Na2R含Na+ 0.4mol,则Na2R的摩尔质量为___,R的相对原子质量为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1mol/LNaOH溶液450mL。根据溶液的配制情况回答下列问题:
(1)如图所示的仪器中,配制溶液肯定不需要的是____(填序号),配制上述溶液还需用到的玻璃仪器是____(填仪器名称)。
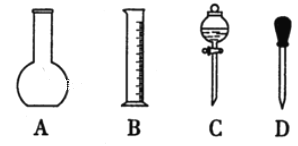
(2)根据计算,用托盘天平称取NaOH的质量为___g。在实验中其他操作均正确,若容量瓶用蒸馏水洗涤后未干燥,则所得溶液浓度____0.1mol/L(填“大于”“小于”或“等于”,下同)。若还未等溶液冷却就定容,则所得溶液浓度___0.1mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金刚砂(SiC)可由SiO2和碳在一定条件下反应制得,反应方程式为SiO2+3C![]() SiC+2CO↑,下列有关制造金刚砂的说法中正确的是
SiC+2CO↑,下列有关制造金刚砂的说法中正确的是
A. 该反应中的氧化剂是SiO2,还原剂为C
B. 该反应中的氧化产物和还原产物的物质的量之比为1∶2
C. 该反应中转移的电子数为12e-
D. 该反应中的还原产物是SiC、氧化产物是CO,其物质的量之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探索二氧化碳在海洋中转移和归宿,是当今海洋科学研究的前沿领域。研究表明,溶于海水的二氧化碳主要以无机碳形式存在,其中HCO3-占95%。科学家利用下图所示装置从海水中提取CO2,有利于减少环境温室气体含量。

下列说法不正确的是
A. a室中OH-在电极板上被氧化
B. b室发生反应的离子方程式为:H+ + HCO3- = CO2↑ + H2O
C. 电路中每有0.2mol 电子通过时,就有0.2mol阳离子从c室移至b室
D. 若用氢氧燃料电池供电,则电池负极可能发生的反应为:H2 + 2OH- - 2e- =2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com