
【题目】如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。下列说法正确的是

A. O2所在的铂电极处发生氧化反应
B. H+透过质子交换膜流向呼气所在的铂电极
C. 电路中流过2mol电子时,消耗标准状况下11.2LO2
D. 该电池的负极反应式为:CH3CH2OH+3H2O-12e-=2CO2+12H+
【答案】C
【解析】A、乙醇燃料电池中,正极上是氧气得电子的还原反应,O2所在的铂电极处发生还原反应,故A错误;B.该电池的负极上乙醇失电子发生氧化反应,由装置图可知酒精在负极被氧气氧化发生氧化反应生成醋酸,CH3CH2OH-4e-+H2O=4H++CH3COOH,所以H+透过质子交换膜流向氧气所在的铂电极,故B错误;C.根据CH3CH2OH-4e-+H2O=4H++CH3COOH,O2 + 4e-- + 4H+ == 2H2O,电路中流过2mol电子时,消耗氧气0.5mol,标准状况下体积为11.2L,故C正确;D、该电池的负极上乙醇失电子发生氧化反应,由装置图可知酒精在负极被氧气氧化发生氧化反应生成醋酸,CH3CH2OH-4e-+H2O=4H++CH3COOH,故D错误;故选C。


科目:高中化学 来源: 题型:
【题目】某小组设计如图所示装置(夹持装置略去),在实验室模拟候氏制碱工艺中NaHCO3的制备。下列说法不正确的是

A. 应先向③中通入足量NH3,再通入足量CO2
B. 装置①也可用于制H2
C. ③中反应的离子方程式为NH3+CO2+H2O=NH4++HCO3-
D. ③、⑤中应分别盛放饱和食盐水和浓氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】航天技术测得三氧化二碳(C2O3)是金星大气层的成份之一,下列关于C2O3的说法中错误的是
A.C2O3与CO2都是碳的氧化物B.C2O3与CO2都是碳酸的酸酐
C.C2O3与CO都具有还原性D.C2O3与C的燃烧产物都是CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组研究NaOH与某些酸之间的反应。
Ⅰ.中和热的测定
在25℃、101kPa条件下,强酸与强碱的稀溶液中和热可表示为:H+(aq)+OH─(aq)=H2O(l) △H=-57.3kJ ·mol-1。按照图1所示装置进行实验。
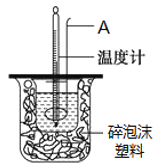
(1)仪器A的名称是________。
(2)碎泡沫塑料的作用是________。
(3)在25℃、101kPa条件下,取50mL 0.50 mol·L-1 CH3COOH溶液、50mL 0.55 mol·L-1 NaOH溶液进行实验,测得的中和热△H________-57. 3 kJ ·mol-1(填“>”“=”或“<”),原因是 ________。
Ⅱ.中和滴定
(1)用_______量取20.00 mL待测稀盐酸溶液放入锥形瓶中,并滴加1~2滴酚酞作指示剂,用0.20 mol·L—1NaOH标准溶液进行滴定。为了减小实验误差,该同学一共进行了三次实验,假设每次所取稀盐酸体积均为20.00 mL,三次实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗NaOH溶液体积/mL | 19.00 | 23.00 | 23.02 |
该盐酸的浓度约为________ (保留两位有效数字)。滴定达到终点的标志是________。
(2)若某次滴定结束时,滴定管液面如图2所示,则终点读数为________mL。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从废旧锂离子二次电池(主要成分为LiCoO2,还含有少量石墨和镀镍金属钢壳、铝箔以及钙等杂质)中回收钴和锂的工艺流程如下:
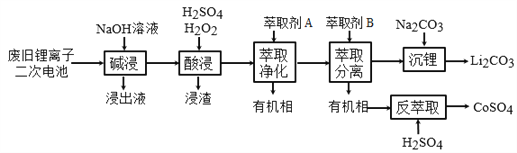
回答下列问题:
(1)“碱浸”的目的是_______。
(2)“酸浸”过程中LiCoO2发生反应的离子方程式为:___________________________
浸渣中含有的主要成分是________________。
(3)“萃取净化”除去的杂质离子有Ni2+外,还有_______。
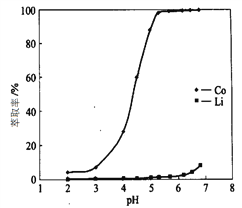
(4)“萃取分离”中钴、锂萃取率与平衡pH关系如图所示, pH一般选择5左右,理由是________。
(5)“沉锂”中Li2CO3溶解度随温度变化曲线如下图所示:
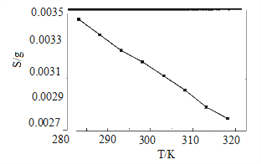
①根据平衡原理分析Li2CO3在水中溶解度随温度变化的原因_____________________。
②为获得高纯Li2CO3,提纯操作依次为趁热过滤、________、烘干。
③若“沉锂”中c(Li+)=1.0 mol·L1,加入等体积等浓度Na2CO3溶液,此时实验所得沉锂率为________。(已知Li2CO3的Ksp为9.0×10-4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,2.24L正戊烷中含有的碳原子数为0.5 NA
B. 1L0.1mol·L-1NaHCO3溶液中所含HCO3-的数目为0.1NA
C. 一定条件下,0.1mol CO与0.1mol H2O(g)充分反应,生成H2的分子数为0.1NA
D. 在反应:3FeS2+12C+8O2=Fe3O4+12CO+6S中,每生成0.6molS,转移的电子数为3.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.二氧化碳是地球温室效应的罪魁祸首,目前人们处理二氧化碳的方法之一是使其与氢气反应合成甲醇。已知氢气、甲醇燃烧的热化学方程式如下:
①2H2(g)+O2(g)=2H2O(l) △H=- 283.0kJ/mol;
②2CH3OH (1)+3O2=2CO2(g)+4H2O(1) △H=- 726.0kJ/mol。
(1)写出二氧化碳与氢气合成甲醇液体的热化学方程式____。
(2)已知:CO2 (g)+3H2 (g)=CH3OH (g)+H2O(g) △H=- 49.0kJ/mol,将6molCO2和8mol H2充入4L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线),图中数据a(l,6)表示在1min时H2的物质的量是6mol。

①b点正反应速率____(填“大于”“等于”或“小于”)逆反应速率。此温度下该反应的平衡常数为____。
②仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图中虚线所示。曲线Ⅱ对应的实验条件改变是____,体积不变再充入3 mol CO2和4mol H2,H2O(g)的体积分数____(填“增大”“不变”或“减小”)
Ⅱ.粗镍样品中含Fe、Zn、Ag、Cu等四种金属杂质,为获得高纯度的镍,某兴趣小组同学拟用铅蓄电池为电源,粗镍及石墨为电极,电解硝酸镍溶液对粗镍进行提纯。(已知,氧化性:Fe2+<Ni2+<Cu2+)
(1)铅蓄电池的负极电极反应式为 ___。
(2)粗镍提纯的阴极反应式为 ___。电解结束后,阳极附近产生的沉淀物的主要成分为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在四个不同的容器中进行合成氨的反应。根据下列在相同时间内测定的结果,判断生成氨的速率最快的是( )
A. v(N2)=0.05 mol·L-1·s-1 B. v(H2)=0.3 mol·L-1·min-1
C. v(N2)=0.2 mol·L-1·min-1 D. v(NH3)=0.3 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝矾石(主要成分是Al2O3,还含有少量杂质SiO2、Fe2O3)是工业上用于炼铝的主要矿物之一,由铝矾石制取金属铝的工艺流程图如下:
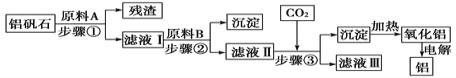
请回答下列有关问题:
(1)下列有关铝矾石以及用铝矾石炼铝的说法中,正确的是________。
A.铝矾石中含有两种类型氧化物
B.铝矾石与河沙含有完全相同的成分
C.铝矾石炼铝需要消耗电能
D.铝矾石炼铝的过程中涉及置换反应
(2)加入原料A时发生反应的离子方程式有_____________。
(3)滤液Ⅱ中所含溶质有__________;步骤③反应的离子方程式为___________。
(4)若步骤③中用氨气代替CO2,步骤③生成沉淀的离子方程式为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com