
【题目】铝矾石(主要成分是Al2O3,还含有少量杂质SiO2、Fe2O3)是工业上用于炼铝的主要矿物之一,由铝矾石制取金属铝的工艺流程图如下:
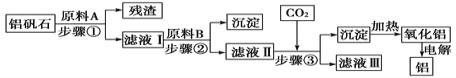
请回答下列有关问题:
(1)下列有关铝矾石以及用铝矾石炼铝的说法中,正确的是________。
A.铝矾石中含有两种类型氧化物
B.铝矾石与河沙含有完全相同的成分
C.铝矾石炼铝需要消耗电能
D.铝矾石炼铝的过程中涉及置换反应
(2)加入原料A时发生反应的离子方程式有_____________。
(3)滤液Ⅱ中所含溶质有__________;步骤③反应的离子方程式为___________。
(4)若步骤③中用氨气代替CO2,步骤③生成沉淀的离子方程式为______________。
【答案】C Al2O3+6H+=2Al3++3H2O,Fe2O3+6H+=2Fe3++3H2O NaOH、NaAlO2 OH-+CO2=HCO3-、CO2+AlO2-+2H2O=Al(OH)3↓+HCO3- Al3++3NH3·H2O=Al(OH)3↓+NH4+
【解析】
氢氧化铝受热分解生成氧化铝,则步骤③中生成的沉淀是氢氧化铝,因此滤液Ⅱ中含有偏铝酸盐,则原料B是强碱,因此滤液Ⅰ中含有铝盐和铁盐,则原料A应该是酸,所以残渣是二氧化硅,结合问题分析解答。
(1)A、铝矾石中含有的SiO2是非金属氧化物,氧化铁是金属氧化物,氧化铝是两性氧化物,因此含有三种类型的氧化物,故A错误;
B、河沙的主要成分为SiO2,因此铝矾石与河沙含有的成分不完全相同,故B错误;
C、电解法炼铝,必定消耗电能,故C正确;
D、步骤①是酸溶解氧化铁和氧化铝,步骤②是碱沉淀铁离子以及把铝离子转化为偏铝酸根离子,步骤③是二氧化碳把偏铝酸根离子转化为氢氧化铝沉淀,氢氧化铝分解以及氧化铝电解均是分解反应,所以铝矾石炼铝的过程中涉及复分解反应、分解反应等,不涉及置换反应,故D错误。
答案选C。
(2)原料A溶解矿石,可利用强酸,分离出不溶物SiO2,反应的离子方程式为Al2O3+6H+=2Al3++3H2O、Fe2O3+6H+=2Fe3++3H2O。
(3)步骤②中可加入强碱例如氢氧化钠,沉淀出Fe3+,使Al3+转化为偏铝酸根离子留在溶液里,所以滤液Ⅱ中所含溶质为NaOH、NaAlO2。通入CO2发生的反应为:OH-+CO2=HCO3-、CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-;
(4)若步骤③中用氨气代替CO2,则滤液Ⅱ中含有铝离子,则步骤③生成沉淀的离子方程式为Al3++3NH3·H2O=Al(OH)3↓+NH4+。


科目:高中化学 来源: 题型:
【题目】如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。下列说法正确的是

A. O2所在的铂电极处发生氧化反应
B. H+透过质子交换膜流向呼气所在的铂电极
C. 电路中流过2mol电子时,消耗标准状况下11.2LO2
D. 该电池的负极反应式为:CH3CH2OH+3H2O-12e-=2CO2+12H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定某铜银合金的组成,将30.0g合金溶于80.0mL 13.5mol·L1的浓HNO3中。待合金完全溶解后,收集到气体6.72L(标准状况下)并测得H+浓度为1mol·L1。假设反应后溶液的体积为80.0mL,试计算:
(1)被还原的硝酸的物质的量___________;
(2)合金中银的质量分数___________。
(3)确定6.72L气体中各成分的物质的量___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室配制 500mL 0.2mol/L 的 NaOH溶液,在下图所示仪器中,配制上述溶液肯定不需要的是____(填序号),除图中已有仪器外, 配制上述溶液还需要的玻璃仪器是_________。
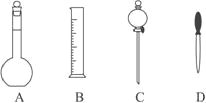
具体过程如下:
①计算需要称量 NaOH 固体的质量_____;
②用少量蒸馏水洗涤烧杯内壁 2~3 次,洗涤液也都注入容量瓶,轻轻晃动容量瓶,使溶液混合均匀;
③用托盘天平称量 NaOH 固体;
④将 NaOH 溶液沿玻璃棒注入_____中;
⑤将称好的 NaOH 固体放入烧杯中,用适量蒸馏水溶解,并____________;
⑥盖好瓶塞,反复上下颠倒,摇匀;
⑦将蒸馏水注入容量瓶,液面离刻度线下_____cm 时,改用_______滴加蒸馏水至液面于刻度线相切;
试回答下列问题:
(2)上述过程的正确顺序为___________(填步骤序号);
(3)经精确测量,最后所得溶液物质的量浓度为 0.192mol/L,原因可能是____________。
A、使用滤纸称量 NaOH 固体; B、未冷却直接转移至容量瓶,立即配好;
C、容量瓶中原来有少量蒸馏水; D、称量时所用的砝码生锈;
E、溶解 NaOH 后的烧杯未经多次洗涤; F、定容时俯视刻度。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于3Br2+6NaOH![]() 5NaBr+NaBrO3+3H2O的反应,下列说法中不正确的是( )
5NaBr+NaBrO3+3H2O的反应,下列说法中不正确的是( )
A. Br 2既是氧化剂,又是还原剂
B. 被氧化的溴原子与被还原的溴原子质量比是1:5
C. NaBr是氧化产物,NaBrO3是还原产物
D. 转移1mol电子时,消耗NaOH 1.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项中的两种物质不论以何种比例混合,只要混合物的总物质的量一定,则完全燃烧消耗O2的质量保持不变的是( )
A. C2H4、C2H6O B. C2H6、C2H6O C. C3H6、C2H4 D. C3H4、C2H6O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各反应中,氧化反应与还原反应在同种元素中进行的是
A.Cl2+2NaOH===NaCl+NaClO+H2O
B.2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
C.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
D.2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粉煤灰的综合利既有利于节约资源又有利于保护环境。某粉煤灰(主要含Al2O3、Fe2O3、CaCO3等)的铝、铁分离工艺流程如下:
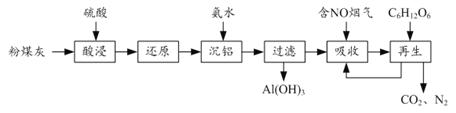
(1)①“酸浸”时Al2O3发生反应的离子方程式为______。
②当硫酸质量分数大于50%,金属氧化物浸出率明显下降。其原因是______。
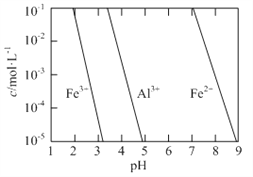
(2)有关金属离子以氢氧化物沉淀时离子浓度随pH变化如图所示。若浸出液不经还原直接与氨水混合,铝、铁元素分离效果较差的原因是______。
(3)沉铝后所得FeSO4溶液可用于烟气中NO吸收,其原理为Fe2++2NO![]() [Fe(NO)2]2+,烟气中O2的体积分数对NO吸收率的影响如图所示。
[Fe(NO)2]2+,烟气中O2的体积分数对NO吸收率的影响如图所示。
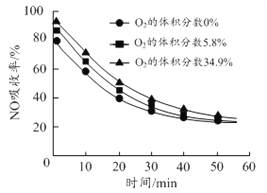
①为提高烟气中NO 的吸收率,可采取的措施有______(答一条,并说明理由)。
②“再生”过程中,[Fe(NO)2]2+在微生物的作用下与C6H12O6发生反应的离子方程式为______。
(4)Al(OH)3经过一系列反应可获得粗铝,利用熔融状态下物质密度不同,通过三层液电解精炼法可由粗铝获得高纯铝(装置如图所示)。
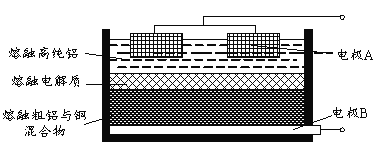
①该装置工作时,电极A作______极。
②熔融粗铝时加入铜的作用是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列浓度关系正确的是( )
A. 0.1mol/L的NH4HSO4溶液中滴加0.1mol/L的Ba(OH)2溶液至沉淀刚好完全:c(NH4+)>c(OH-)>c(SO42-)>c(H+)
B. 若将CO2通入0.1mol/LNa2CO3溶液至溶液中性,则溶液中: 2c(CO32-)+c(HCO3-)=0.1mol/L
C. 0.1mol/L的NaOH溶液与0.2mol/L的HCN溶液等体积混合,所得溶液呈碱性:c(Na+)>c(CN-)>c(HCN)>c(OH-)>c(H+)
D. 向1L 1mol/L的KOH热溶液中通入一定量的Cl2,恰好完全反应生成氯酸钾、次氯酸钾和氯化钾的混合溶液:c(K+)+c(H+)=6c(ClO3-)+2c(ClO-)+c(HClO)+c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com