
【题目】为了测定某铜银合金的组成,将30.0g合金溶于80.0mL 13.5mol·L1的浓HNO3中。待合金完全溶解后,收集到气体6.72L(标准状况下)并测得H+浓度为1mol·L1。假设反应后溶液的体积为80.0mL,试计算:
(1)被还原的硝酸的物质的量___________;
(2)合金中银的质量分数___________。
(3)确定6.72L气体中各成分的物质的量___________。
【答案】0.3mol 36% n(NO)=0.2mol;n(NO2)=0.1
【解析】
(1)硝酸与金属反应不论是被还原为NO还是NO2,根据氮原子守恒可知被还原的硝酸的物质的量即为生成气体的物质的量,所以被还原的硝酸的物质的量为6.72 L÷22.4 molL-1=0.3 mol。
(2)剩余硝酸是1mol/L×0.08L=0.08mol,则参加反应的硝酸为13.5mol/L×0.08L-0.08mol=1.0mol。设合金中Cu和Ag的物质的量分别为x mol和y mol,则64.0x+108y=30.0,根据氮原子守恒可知2x+y=1.0-0.3=0.7,解得:x=0.3、y=0.1,所以银的质量分数为![]() ;
;
(3)设混合气体中NO、NO2的物质的量分别是a mol、b mol,则a+b=0.3,根据电子得失守恒可知3a+b=0.3×2+0.1,解得a=0.2、b=0.1,即6.72L气体中NO为0.2mol,NO2为0.1mol。


科目:高中化学 来源: 题型:
【题目】在N2F2分子中,所有原子均符合8电子稳定结构,则该分子中的共价键类型是
A. 仅有σ键 B. 三个σ键,两个π键
C. 两个σ键,两个π键 D. 三个σ键,一个π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅单质及其化合物的说法正确的是
①硅是构成一些岩石和矿物的基本元素
②水泥、玻璃、陶瓷都是硅酸盐产品
③高纯度的硅单质广泛用于制作光导纤维
④普通玻璃是氧化物,成分可表示为SiO2
⑤粗硅制备单晶硅不涉及氧化还原反应
A. ①② B. ①②③ C. ①②③④ D. ②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.阴阳离子之间通过静电引力形成的化学键,叫离子键
B.在共价化合物中不可能含有离子键
C.含有共价键的化合物一定是共价化合物
D.含有离子键的化合物不一定是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)NaN3是气体发生剂,受热分解产生N2和Na,N2的电子式为____________。
(2)Fe2O3是主氧化剂,与Na反应生成的还原产物为_________________(已知该反应为置换反应),铁的外围电子排布式为_______________________:
(3)KClO4是助氧化剂,反应过程中与Na作用生成KCl和Na2O。KClO4含有化学键的类型为______,K的原子结构示意图为_______________________。
(4)NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知软锰矿和锰结核矿的主要成分均为MnO2,二氧化锰的制备和性质在生产生活和化学实验中有广泛应用。
二氧化锰的制备:
锰粉的主要成分为NH4Cl、C和MnO2,将锰粉进行如图所示操作后,可得到二氧化锰固体。

(1)某同学认为试剂a为蒸馏水,你认为______(填“能”或“不能”)实现实验目的。
(2)操作1的名称是______,所用到的玻璃仪器有烧杯、玻璃棒和______。
(3)在空气中充分灼烧的目的是_________。
二氧化锰的性质检验:
Ⅰ.氧化性
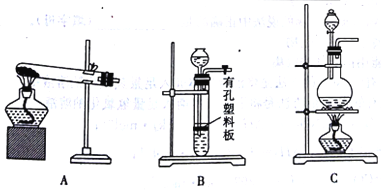
(4)实验室用MnO2与浓盐酸反应制备Cl2,可以选用的装置是______(填字母)。
(5)将MnO2放在NH3气流中加热,可得到棕黑色的Mn2O3和N2,该反应的化学方程式为_______。
Ⅱ.还原性
(6)下列流程所发生的反应中,氧化剂与还原剂的物质的量之比为______。
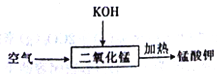
Ⅲ.催化性
MnO2是实验室制取O2的催化剂。某同学设计实验探究双氧水分解的实验方案如下表所示。
实验序号 | w(H2O2)/% | 粉状MnO2/g | 温度/℃ | 待测数据 |
① | 5 | 0 | 20 | |
② | 5 | 1.0 | 20 |
(7)本实验的待测数据是___________。
(8)由实验①和②可得出的结论是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PbO(溶于酸,微溶于强碱溶液)在工业上用途广泛,可制作颜料铅白、杀虫剂等。某再生能源企业以含铅废料(主要含Pb、PbO、PbSO4和极少量的PbO2)和稀H2SO4为原料制备高纯PbO的工艺流程如下:

(1)含铅废料中的PbO2和PbSO4中,铅的化合价分别为____________、____________。
(2)酸溶过程中为了加快溶解速率,除了加入FeSO4作催化剂外,还可采取的措施有____________________(任写一种)。
(3)滤液A中含有的主要阳离子是____________________(填离子符号)。
(4)脱硫过程发生的主要反应的离子方程式为________________________________。
(5)冷却、过滤后对所得的固体进行洗涤操作,在实验室洗涤时,所用到的玻璃仪器有烧杯、_________和_________,检验沉淀是否洗涤干净的方法是________________________________。
(6)PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)![]() NaHPbO2(aq)。PbO的溶解度曲线如图所示。结合该曲线,简述由粗品PbO得到高纯PbO的操作:_______________________________。
NaHPbO2(aq)。PbO的溶解度曲线如图所示。结合该曲线,简述由粗品PbO得到高纯PbO的操作:_______________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质的分类、名称(或俗名)、化学式都正确的是( )
A.金属氧化物、氧化铁、FeO
B.非金属氧化物、二氧化硫 、SO2
C.碱性氧化物、 过氧化钠 、 Na2O2
D.碱 、 纯碱 、 Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
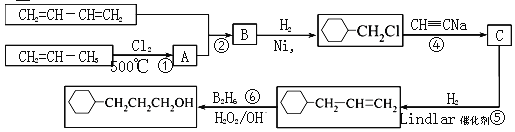
【题目】工业上以1,3-丁二烯,丙烯,乙炔等为原料合成![]() 流程图如下
流程图如下
已知:有机反应中有一种双烯加成反应,如:CH2=CH—CH=CH2+CH2=CH2→ 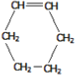 。
。
(1)反应①的反应类型是______________,B中含有的官能团的名称________________。
(2)写出反应②的化学方程式__________________________。
(3)写出C的结构简式_______________。
(4)写出![]() 含有六元环且核磁共振氢谱有4组峰的同分异构体的结构简式__________。
含有六元环且核磁共振氢谱有4组峰的同分异构体的结构简式__________。
(5)根据以上合成信息,以乙烯为原料合成1,6—己二醇,其他试剂任选,写出合成的流程图________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com