
【题目】(1)实验室配制 500mL 0.2mol/L 的 NaOH溶液,在下图所示仪器中,配制上述溶液肯定不需要的是____(填序号),除图中已有仪器外, 配制上述溶液还需要的玻璃仪器是_________。
具体过程如下:
①计算需要称量 NaOH 固体的质量_____;
②用少量蒸馏水洗涤烧杯内壁 2~3 次,洗涤液也都注入容量瓶,轻轻晃动容量瓶,使溶液混合均匀;
③用托盘天平称量 NaOH 固体;
④将 NaOH 溶液沿玻璃棒注入_____中;
⑤将称好的 NaOH 固体放入烧杯中,用适量蒸馏水溶解,并____________;
⑥盖好瓶塞,反复上下颠倒,摇匀;
⑦将蒸馏水注入容量瓶,液面离刻度线下_____cm 时,改用_______滴加蒸馏水至液面于刻度线相切;
试回答下列问题:
(2)上述过程的正确顺序为___________(填步骤序号);
(3)经精确测量,最后所得溶液物质的量浓度为 0.192mol/L,原因可能是____________。
A、使用滤纸称量 NaOH 固体; B、未冷却直接转移至容量瓶,立即配好;
C、容量瓶中原来有少量蒸馏水; D、称量时所用的砝码生锈;
E、溶解 NaOH 后的烧杯未经多次洗涤; F、定容时俯视刻度。
【答案】C 玻璃棒、烧杯 4g 500mL容量瓶 冷却到室温 1~2 胶头滴管 ①③⑤④②⑦⑥ AE
【解析】
根据配制一定物质的量浓度溶液的操作、误差分析及注意事项分析解答。
(1)配制一定物质的量浓度溶液需要烧杯、玻璃棒、胶头滴管、500mL容量瓶,托盘天平或量筒,不需要分液漏斗;
故答案为:C ;玻璃棒、烧杯;
①配制 500mL 0.2mol/L 的 NaOH溶液,NaOH的物质的量为:n(NaOH)=0.2mol/L×0.5L=0.1mol,所以需要m(NaOH)=n×M=0.1mol×40g/mol=4g;④操作是转移,需要用玻璃棒引流,转移到500mL容量瓶中,⑤操作是将NaOH固体溶解,冷却后转移,⑦操作是定容,将蒸馏水注入容量瓶,液面离刻度线下1-2cm处时,改用胶头滴管滴加蒸馏水至液面于刻度线相切;
故答案为:4g ;500mL容量瓶 ;冷却到室温;1~2 ;胶头滴管;
(2) 配制一定物质的量浓度溶液的操作流程是称量——溶解——冷却——转移——洗涤——定容——摇匀——装瓶贴标签;
故答案为:①③⑤④②⑦⑥;
(3) 最后所得溶液物质的量浓度为 0.192mol/L比配制浓度偏小,
A.称量氢氧化钠固体时,使用滤纸称量 NaOH 固体,使得固体药品沾在滤纸上,溶质的物质的量减小,导致配制溶液的浓度偏小,故A正确;
B. 若未冷却直接转移至容量瓶,立即配好,溶液体积偏小,导致溶液浓度偏大,故B错误;
C. 容量瓶中原来有少量蒸馏水对配制溶液的浓度无影响,故C错误;
D. 称量时所用的砝码生锈,导致砝码实际质量增加,所以会导致固体溶质比砝码标的质量多,即会导致溶液浓度增大,故C错误;
E. 溶解 NaOH 后,会有少量NaOH沾在烧杯壁和玻璃棒上,使溶质质量减小,导致溶液浓度偏小,故E正确;
故答案为:AE。


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
【题目】某学习小组研究NaOH与某些酸之间的反应。
Ⅰ.中和热的测定
在25℃、101kPa条件下,强酸与强碱的稀溶液中和热可表示为:H+(aq)+OH─(aq)=H2O(l) △H=-57.3kJ ·mol-1。按照图1所示装置进行实验。
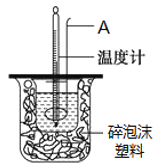
(1)仪器A的名称是________。
(2)碎泡沫塑料的作用是________。
(3)在25℃、101kPa条件下,取50mL 0.50 mol·L-1 CH3COOH溶液、50mL 0.55 mol·L-1 NaOH溶液进行实验,测得的中和热△H________-57. 3 kJ ·mol-1(填“>”“=”或“<”),原因是 ________。
Ⅱ.中和滴定
(1)用_______量取20.00 mL待测稀盐酸溶液放入锥形瓶中,并滴加1~2滴酚酞作指示剂,用0.20 mol·L—1NaOH标准溶液进行滴定。为了减小实验误差,该同学一共进行了三次实验,假设每次所取稀盐酸体积均为20.00 mL,三次实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗NaOH溶液体积/mL | 19.00 | 23.00 | 23.02 |
该盐酸的浓度约为________ (保留两位有效数字)。滴定达到终点的标志是________。
(2)若某次滴定结束时,滴定管液面如图2所示,则终点读数为________mL。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在四个不同的容器中进行合成氨的反应。根据下列在相同时间内测定的结果,判断生成氨的速率最快的是( )
A. v(N2)=0.05 mol·L-1·s-1 B. v(H2)=0.3 mol·L-1·min-1
C. v(N2)=0.2 mol·L-1·min-1 D. v(NH3)=0.3 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列用于解释事实的离子方程式书写正确的是
A.铁粉溶于氯化铁溶液:Fe+2Fe3+=3Fe2+
B.硫化钠溶液呈碱性:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
C.氯水具有漂白性:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
D.工业上利用电解饱和食盐水制氯气:2H++2Cl-![]() H2↑+Cl2↑
H2↑+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应8NH3+3Cl2==6NH4Cl+N2,回答下列问题:
(1)当有34gNH3参加反应时,被氧化的物质的质量为_____ g,生成的还原产物的质量为_______g。
(2)在反应:K2Cr2O7+14HCl(浓)===2KCl+2CrCl3+3Cl2↑+7H2O中,用氧化还原反应的知识____是氧化剂,_____是还原剂,用“双线桥法”表示反应中电子转移的方向和数目:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】84消毒液(有效成分是次氯酸钠)、漂白粉(有效成分是次氯酸钙)等物质是日常生活中常用的消毒剂,广泛应用于日常生活中。根据下列要求回答相关问题:
(1)在0.1 mol·L-1的84消毒液中滴加几滴酚酞试液,可能观察到的现象是______________,写出反应的离子方程式:______________________________。
(2)某同学测定漂白粉溶液pH的操作方法:将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液滴在试纸上,大约半分钟后,再与标准比色卡对照。你认为他能否达到实验目的?________(填“能”或“否”)。
(3)下列关于0.5 mol·L-1 NaClO溶液中各粒子浓度的关系式正确的是____________。
A.c(OH-)>c(H+)>c(Na+)>c(ClO-) B.c(Na+)=c(ClO-)+c(HClO)
C.c(Na+)>c(ClO-)>c(OH-)>c(H+) D.c(Na+)+c(H+)=c(ClO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝矾石(主要成分是Al2O3,还含有少量杂质SiO2、Fe2O3)是工业上用于炼铝的主要矿物之一,由铝矾石制取金属铝的工艺流程图如下:
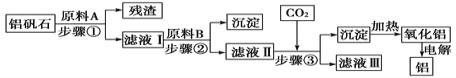
请回答下列有关问题:
(1)下列有关铝矾石以及用铝矾石炼铝的说法中,正确的是________。
A.铝矾石中含有两种类型氧化物
B.铝矾石与河沙含有完全相同的成分
C.铝矾石炼铝需要消耗电能
D.铝矾石炼铝的过程中涉及置换反应
(2)加入原料A时发生反应的离子方程式有_____________。
(3)滤液Ⅱ中所含溶质有__________;步骤③反应的离子方程式为___________。
(4)若步骤③中用氨气代替CO2,步骤③生成沉淀的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化锂(Li2O)是锂电池工业的重要原料。以粗碳酸锂为原料制备氧化锂的一种工艺流程如下:
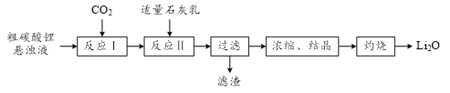
注:常温下,碳酸锂微溶于水,氢氧化锂可溶于水。
(1)反应Ⅰ中通入CO2需加压的原因是______。
(2)①反应Ⅱ生成LiOH的化学方程式为______。
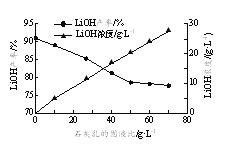
②石灰乳的固液比[Ca(OH)2的质量与H2O的体积之比]对LiOH产率和滤液中LiOH浓度的影响如右图所示。实际生产中选择固液比25 g·L-1,若固液比过低对后续操作的不利影响是______。
(3)浓缩、结晶所得LiOH·H2O通过灼烧得到Li2O。
①LiOH·H2O中常含有少量的Li2CO3,但该物质对所制Li2O得纯度无影响,其原因是______。
②将LiOH·H2O置于不同坩埚内,在空气中充分灼烧,反应后固体产物的XRD图谱如右图所示(XRD图谱可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。欲制得高纯氧化锂最适宜的坩埚是______。铁坩埚中发生反应的化学方程式为______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若定义pC是溶液中微粒物质的量浓度的负对数,则常温下,一定浓度的某酸(H2A)水溶液中pC(H2A)、pC(HAˉ)、pC(A2-)随着溶液pH的变化曲线如图所示。下列说法一定正确的是
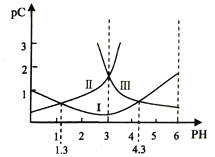
A. pH=4时,c(HAˉ)<c(A2-)
B. c(H2A)+c(HAˉ)+c(A2-)是定值
C. 该酸的电离常数Ka1=10-1.3
D. 常温下,NaHA的水溶液呈碱性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com