
【题目】若定义pC是溶液中微粒物质的量浓度的负对数,则常温下,一定浓度的某酸(H2A)水溶液中pC(H2A)、pC(HAˉ)、pC(A2-)随着溶液pH的变化曲线如图所示。下列说法一定正确的是
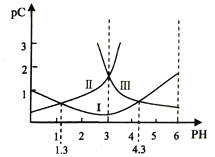
A. pH=4时,c(HAˉ)<c(A2-)
B. c(H2A)+c(HAˉ)+c(A2-)是定值
C. 该酸的电离常数Ka1=10-1.3
D. 常温下,NaHA的水溶液呈碱性
【答案】C
【解析】
随PH增大,C(H2A)减小、C(HAˉ)先增后减、C(A2-)增大;根据图示,曲线Ⅰ表示c(HAˉ)、曲线Ⅱ表示c(H2A)、曲线Ⅲ表示c(A2-);根据图示,pH=4时,c(HAˉ)>c(A2-),故A错误;调节溶液PH的方法不确定,所以c(H2A)+c(HAˉ)+c(A2-)不一定是定值,故B错误;根据图示c(H2A)= c(HAˉ)时,pH=1.3,所以Ka1=![]() = 10-1.3,故C正确;根据图示c(A2-)= c(HAˉ)时,pH=4.3,Ka2=
= 10-1.3,故C正确;根据图示c(A2-)= c(HAˉ)时,pH=4.3,Ka2=![]() ,HAˉ的水解常数=
,HAˉ的水解常数=![]() ,电离大于水解,所以NaHA的水溶液呈酸性,故D错误。
,电离大于水解,所以NaHA的水溶液呈酸性,故D错误。
电解:酸式弱酸盐NaHA溶液酸碱性的判断方法:若HAˉ的电离平衡常数大于HAˉ的水解平衡常数,溶液呈酸性;若HAˉ的电离平衡常数小于HAˉ的水解平衡常数,溶液呈碱性。


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
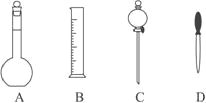
【题目】(1)实验室配制 500mL 0.2mol/L 的 NaOH溶液,在下图所示仪器中,配制上述溶液肯定不需要的是____(填序号),除图中已有仪器外, 配制上述溶液还需要的玻璃仪器是_________。
具体过程如下:
①计算需要称量 NaOH 固体的质量_____;
②用少量蒸馏水洗涤烧杯内壁 2~3 次,洗涤液也都注入容量瓶,轻轻晃动容量瓶,使溶液混合均匀;
③用托盘天平称量 NaOH 固体;
④将 NaOH 溶液沿玻璃棒注入_____中;
⑤将称好的 NaOH 固体放入烧杯中,用适量蒸馏水溶解,并____________;
⑥盖好瓶塞,反复上下颠倒,摇匀;
⑦将蒸馏水注入容量瓶,液面离刻度线下_____cm 时,改用_______滴加蒸馏水至液面于刻度线相切;
试回答下列问题:
(2)上述过程的正确顺序为___________(填步骤序号);
(3)经精确测量,最后所得溶液物质的量浓度为 0.192mol/L,原因可能是____________。
A、使用滤纸称量 NaOH 固体; B、未冷却直接转移至容量瓶,立即配好;
C、容量瓶中原来有少量蒸馏水; D、称量时所用的砝码生锈;
E、溶解 NaOH 后的烧杯未经多次洗涤; F、定容时俯视刻度。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粉煤灰的综合利既有利于节约资源又有利于保护环境。某粉煤灰(主要含Al2O3、Fe2O3、CaCO3等)的铝、铁分离工艺流程如下:
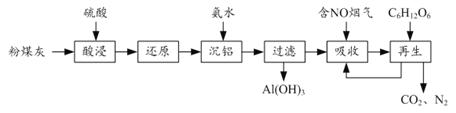
(1)①“酸浸”时Al2O3发生反应的离子方程式为______。
②当硫酸质量分数大于50%,金属氧化物浸出率明显下降。其原因是______。
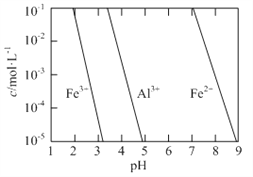
(2)有关金属离子以氢氧化物沉淀时离子浓度随pH变化如图所示。若浸出液不经还原直接与氨水混合,铝、铁元素分离效果较差的原因是______。
(3)沉铝后所得FeSO4溶液可用于烟气中NO吸收,其原理为Fe2++2NO![]() [Fe(NO)2]2+,烟气中O2的体积分数对NO吸收率的影响如图所示。
[Fe(NO)2]2+,烟气中O2的体积分数对NO吸收率的影响如图所示。
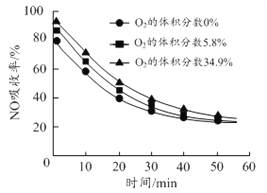
①为提高烟气中NO 的吸收率,可采取的措施有______(答一条,并说明理由)。
②“再生”过程中,[Fe(NO)2]2+在微生物的作用下与C6H12O6发生反应的离子方程式为______。
(4)Al(OH)3经过一系列反应可获得粗铝,利用熔融状态下物质密度不同,通过三层液电解精炼法可由粗铝获得高纯铝(装置如图所示)。
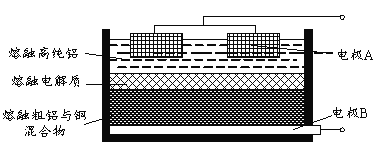
①该装置工作时,电极A作______极。
②熔融粗铝时加入铜的作用是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下实验装置,测定葡萄糖还原新制氢氧化铜所得红色物质的组成。下列说法中正确的是

A. 将装置a中的Zn换成CaCO3也可制备CO2气体
B. 若撤去b装置,则会导致该物质含氧量测定结果偏低
C. 只需称量装置d反应前后的质量就可确定该物质的组成
D. 装置e的作用是防止空气中的H2O、CO2等进入装置d中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是 ( )
A. 氢氧化钠溶液与稀醋酸反应:OH-+H+=H2O
B. 碳酸钙与足量稀硝酸反应:CaCO3+2H+=Ca2++H2O+CO2↑
C. 氯化铝溶液与过量氨水反应:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
D. 钠与水反应:Na+2H2O=Na++2OH-+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性,下列说法正确的是
A. X、Y、Z、W的原子半径依次减小
B. W与X形成的化合物中只含离子键
C. W的气态氢化物的沸点一定高于Z的气态氢化物的沸点
D. 若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列浓度关系正确的是( )
A. 0.1mol/L的NH4HSO4溶液中滴加0.1mol/L的Ba(OH)2溶液至沉淀刚好完全:c(NH4+)>c(OH-)>c(SO42-)>c(H+)
B. 若将CO2通入0.1mol/LNa2CO3溶液至溶液中性,则溶液中: 2c(CO32-)+c(HCO3-)=0.1mol/L
C. 0.1mol/L的NaOH溶液与0.2mol/L的HCN溶液等体积混合,所得溶液呈碱性:c(Na+)>c(CN-)>c(HCN)>c(OH-)>c(H+)
D. 向1L 1mol/L的KOH热溶液中通入一定量的Cl2,恰好完全反应生成氯酸钾、次氯酸钾和氯化钾的混合溶液:c(K+)+c(H+)=6c(ClO3-)+2c(ClO-)+c(HClO)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是铅蓄电池的工作原理示意图,电池总反应式是Pb+PbO2+2H2SO4 ![]() 2PbSO4+2H2O,则下列说法正确的是
2PbSO4+2H2O,则下列说法正确的是

A. 放电时:PbO2做负极
B. 充电时:硫酸浓度增大
C. 充电时:B应与电源的正极相连
D. 放电时:正极反应是Pb-2e-+SO![]() =PbSO4
=PbSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是
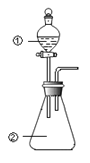
选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
C | 氯化铁溶液 | 淀粉碘化钾溶液 | 溶液变为蓝色 |
D | 硫酸亚铁溶液 | 过氧化钠固体 | 产生气泡和白色沉淀 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com