
【题目】某同学设计如下实验装置,测定葡萄糖还原新制氢氧化铜所得红色物质的组成。下列说法中正确的是

A. 将装置a中的Zn换成CaCO3也可制备CO2气体
B. 若撤去b装置,则会导致该物质含氧量测定结果偏低
C. 只需称量装置d反应前后的质量就可确定该物质的组成
D. 装置e的作用是防止空气中的H2O、CO2等进入装置d中
科目:高中化学 来源: 题型:
【题目】下列用于解释事实的离子方程式书写正确的是
A.铁粉溶于氯化铁溶液:Fe+2Fe3+=3Fe2+
B.硫化钠溶液呈碱性:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
C.氯水具有漂白性:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
D.工业上利用电解饱和食盐水制氯气:2H++2Cl-![]() H2↑+Cl2↑
H2↑+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化锂(Li2O)是锂电池工业的重要原料。以粗碳酸锂为原料制备氧化锂的一种工艺流程如下:
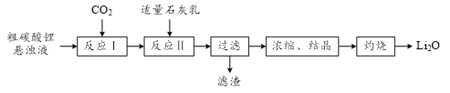
注:常温下,碳酸锂微溶于水,氢氧化锂可溶于水。
(1)反应Ⅰ中通入CO2需加压的原因是______。
(2)①反应Ⅱ生成LiOH的化学方程式为______。
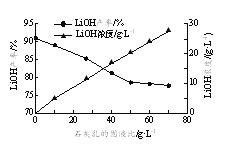
②石灰乳的固液比[Ca(OH)2的质量与H2O的体积之比]对LiOH产率和滤液中LiOH浓度的影响如右图所示。实际生产中选择固液比25 g·L-1,若固液比过低对后续操作的不利影响是______。
(3)浓缩、结晶所得LiOH·H2O通过灼烧得到Li2O。
①LiOH·H2O中常含有少量的Li2CO3,但该物质对所制Li2O得纯度无影响,其原因是______。
②将LiOH·H2O置于不同坩埚内,在空气中充分灼烧,反应后固体产物的XRD图谱如右图所示(XRD图谱可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。欲制得高纯氧化锂最适宜的坩埚是______。铁坩埚中发生反应的化学方程式为______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M(C25H44O8)是一种新型治疗高血压病的药物,工业上用淀粉、烃A为基本原料合成M的路线如下图所示。
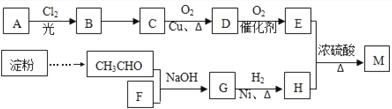
已知:I.烃A的相对分子质量为72,且分子中只有一种氢原子;B分子中核磁共振氢谱有2个峰,且面积比为9:2;35%-40%的F的水溶液被称为福尔马林。
II.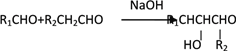
(1)A的名称为____________________(系统命名法),B的结构简式为_____________________,F的分子式为_____________。
(2)B→C的反应条件是___________________,G的官能团名称是________________________。
(3)D与银氨溶液反应的化学方程式为_________________________________________________。
(4)E有多种同分异构体,其中能发生银镜反应且属于酯类的同分异构体共有____________种,其中核磁共振氢谱有2个峰的物质结构简式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的废金属屑中主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3,为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。
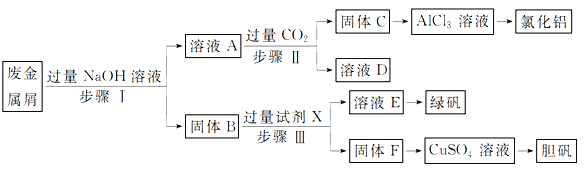
请回答:
(1)写出步骤Ⅰ反应的离子方程式:____________________________。
(2)试剂X是______________。溶液D是______________。
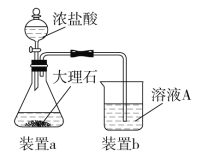
(3)在步骤Ⅱ时,用如图装置制取CO2并通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体C减少,可采取的改进措施是_____________________。
(4)由固体F制取硫酸铜溶液,通常有两种方案:
方案一:将固体F在加热条件下与浓硫酸反应;
方案二:将固体F投入热的稀浓硫酸中,然后通入氧气;
方法一的缺点为:_________________________________________________。
(5)工业上常用溶液E制得净水剂Na2FeO4,流程如下:

①测得溶液E中c(Fe2+)为0.2 mol·L-1,若要处理1 m3溶液E,理论上需要消耗25%的H2O2溶液_______kg。
②写出由Fe(OH)3制取Na2FeO4的离子方程式______________。(已知NaClO还原为NaCl)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为光伏发电电解甲基肼[CH3-NH-NH2]制氢的装置示意图(电解池中交换膜仅阻止气体通过,a、b极均为惰性电极)。下列叙述中正确的是
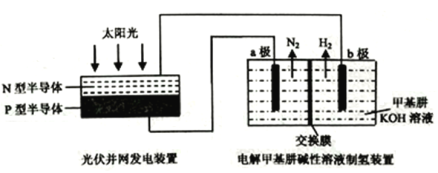
A. N型半导体为正极,P型半导体为负极
B. 制氢装置溶液中电子从a极流向b极
C. 工作时,产生的N2、H2体积比为1:3(同温同压)
D. 工作时,a极的电极反应式为CH3-NH-NH2+12OHˉ-10eˉ=CO32-+N2↑+9H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若定义pC是溶液中微粒物质的量浓度的负对数,则常温下,一定浓度的某酸(H2A)水溶液中pC(H2A)、pC(HAˉ)、pC(A2-)随着溶液pH的变化曲线如图所示。下列说法一定正确的是
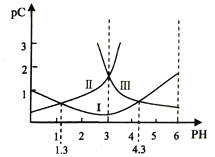
A. pH=4时,c(HAˉ)<c(A2-)
B. c(H2A)+c(HAˉ)+c(A2-)是定值
C. 该酸的电离常数Ka1=10-1.3
D. 常温下,NaHA的水溶液呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知某烷烃的键线式为![]() ,
,
①用系统命名法命名该烷烃:___________________。
②若该烷烃是由烯烃和1molH2加成得到的,则原烯烃的结构有___________种。(不包括立体异构,下同)
③该烷烃在光照条件下与氯气反应,生成的一氯代烷最多有__________种。
(2)某有机物X由C、H、O三种元素组成,经测定其相对分子质量为90。取1.8gX在纯氧中完全燃烧,将产物先后通过浓硫酸和碱石灰,两者分别增重1.08g和2.64g。则有机物X的分子式为___________。已知有机物X含有一个一COOH,在1H-NMR 谱上观察氢原子给出四种特征峰,强度为3:1:1:l 。则X 的结构简式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学进行下列实验:
操作 | 现象 |
取一块打磨过的生铁片,在其表面滴1滴含酚酞和K3[Fe(CN)6]的食盐水
| 放置一段时间后,生铁片上出现如图所示“斑痕”。边缘处为红色,中心区域为蓝色,在两色环交界处出现铁锈
|
下列对实验现象解释不正确的是
A. 中心区为蓝色的原因是铁失电子被氧化,Fe2+与K3[Fe(CN)6]反应生成蓝色沉淀
B. 边缘处为红色的原因是发生吸氧腐蚀,生成了OH-,使溶液中c(OH-)>c(H+)
C. 边缘处为红色的原因是发生析氢腐蚀,消耗了H+,打破了水的电离平衡,使c(OH-)>c(H+)
D. 交界处出现铁锈的原因是4Fe2++8OH-+O2+2H2O=4Fe(OH)3,Fe(OH)3分解得到铁锈
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com