
【题目】下图为光伏发电电解甲基肼[CH3-NH-NH2]制氢的装置示意图(电解池中交换膜仅阻止气体通过,a、b极均为惰性电极)。下列叙述中正确的是
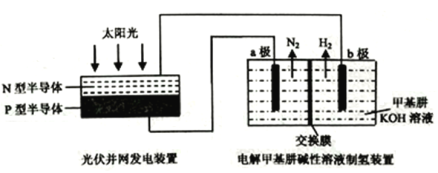
A. N型半导体为正极,P型半导体为负极
B. 制氢装置溶液中电子从a极流向b极
C. 工作时,产生的N2、H2体积比为1:3(同温同压)
D. 工作时,a极的电极反应式为CH3-NH-NH2+12OHˉ-10eˉ=CO32-+N2↑+9H2O
科目:高中化学 来源: 题型:
【题目】为了提高资源利用率,减少环境污染,化工集团将钛厂、氯碱厂和甲醇厂组成产业链,如图所示。
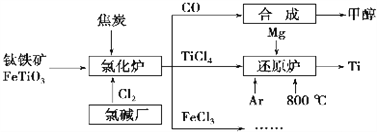
请填写下列空白:
(1)钛铁矿进入氯化炉前通常采取洗涤、粉碎、烘干、预热等物理方法处理,请从原理上解释粉碎的作用:_______________________________________;
(2)已知氯化炉中反应氯气和焦炭的理论用料物质的量比为7∶ 6,则氯化炉中的化学方程为_________________________________________________。
(3)TiCl4在常温下为无色液体,在军事上可作为人造烟雾剂,因为它在湿空气中会大冒白烟,水解生成二氧化钛的水凝胶TiO2·xH2O(也常写成H2TiO),工业上可也用此反应制备TiO2。请写出该水解方程式__________________________________________(用TiO2·xH2O或H2TiO表示均可),工业上用TiCl4制备TiO2·xH2O时要加入大量的水,同时加热,目的是:______________________________
(4)Ar气通入还原炉中并不参与反应,通入Ar气的作用是__________________________
(5)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。已知该燃料电池的总反应式为2CH3OH+3O2+4OH-= 2CO32-+6H2O,工作一段时间后,测得溶液的pH_____(填“减小”、“增大”或“不变”)。
(6)FeCl3溶液可作为印刷电路铜板的腐蚀液,写出该反应的离子方程式_____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不属于氧化还原反应的是
A. AgNO3+NaCl===AgCl↓+NaNO3 B. 3CO+Fe2O3![]() 2Fe+3CO2
2Fe+3CO2
C. 2F2+2H2O===4HF+O2 D. MgCl2(熔融) ![]() Mg+Cl2↑
Mg+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖酸亚铁[(C6H11O7)2Fe2H2O]是重要的矿物质添加剂,它的吸收效果比无机铁盐好。一种工业上制备葡萄糖酸亚铁的工艺流程如下:
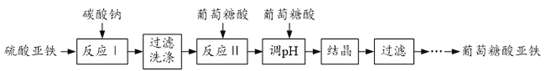
(1)反应Ⅰ的化学方程式为______。
(2)①碳酸亚铁过滤时需在表面保留水层的原因是______;
②检验FeCO3已经洗涤干净的操作为______。
(3)反应Ⅱ后加入葡萄糖酸调节溶液pH至5.8,其原因是______。
(4)葡萄糖酸亚铁溶液结晶、洗涤时均需加入乙醇,其目的分别是______,______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下实验装置,测定葡萄糖还原新制氢氧化铜所得红色物质的组成。下列说法中正确的是

A. 将装置a中的Zn换成CaCO3也可制备CO2气体
B. 若撤去b装置,则会导致该物质含氧量测定结果偏低
C. 只需称量装置d反应前后的质量就可确定该物质的组成
D. 装置e的作用是防止空气中的H2O、CO2等进入装置d中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《有机化学基础》
(1) 分子中的官能团与有机化合物的性质密切相关。
①下列化合物中与![]() 互为同系物的是____(填字母)。
互为同系物的是____(填字母)。
a. ![]() b.
b. ![]() c.
c. ![]()
②下列化合物中,常温下能使酸性高锰酸钾溶液褪色的是____(填字母)。
a. CH3CH3 b. HC≡CH c. CH3COOH
③下列化合物中,能发生酯化反应的是____(填字母)。
a. CH3CH2Cl b. CH3CHO c. CH3CH2OH
(2) 化合物X(![]() )是一种合成液晶材料的化工原料。
)是一种合成液晶材料的化工原料。
①1 mol X在一定条件下最多能与____mol H2发生加成反应。
②X在酸性条件下水解可生成![]() 和________(用结构简式表示)。
和________(用结构简式表示)。
③![]() 分子中最多有____个碳原子共平面。
分子中最多有____个碳原子共平面。
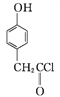
(3) 化合物D是一种医药中间体,可通过下列方法合成。
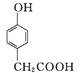 A
A![]()
 B
B ![]()
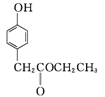 C
C ![]()
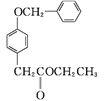 D
D
①A→B的反应类型为____。
②D中含氧官能团有____和____(填名称)。
③C→D的反应中有HCl生成,则M的结构简式为_______。
④E是A的一种同分异构体,E分子的核磁共振氢谱共有4个吸收峰,能发生银镜反应,能与FeCl3溶液发生显色反应。E的结构简式为___________(任写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性,下列说法正确的是
A. X、Y、Z、W的原子半径依次减小
B. W与X形成的化合物中只含离子键
C. W的气态氢化物的沸点一定高于Z的气态氢化物的沸点
D. 若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于说法正确的是( )
A. HCl和NaOH反应的中和热△H=﹣57.3 kJ/mol。则H2SO4和Ba(OH)2反应的中和热△H=2×(﹣57.3) kJ/mol
B. 已知C2H5OH(l)的燃烧热是1366.8 kJ/mol,则C2H5OH(l)+3O2(g) ═ 2CO2(g)+3H2O(g) 反应的△H=-1366.8 kJ/mol
C. 一定条件下2SO2(g)+O2(g)![]() 2SO3(g) △H1<0,2SO2(g)+O2(g)
2SO3(g) △H1<0,2SO2(g)+O2(g)![]() 2SO3(l) △H2<0,则△H1>△H2
2SO3(l) △H2<0,则△H1>△H2
D. 在一定温度和压强下,将0.5mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放出热量19.3 kJ,则其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) △H=﹣38.6kJ/mol
2NH3(g) △H=﹣38.6kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取等物质的量浓度的NaOH溶液两份A和B,每份100mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生的CO2气体体积与所加的盐酸体积之间的关系如图所示。下列说法正确的是
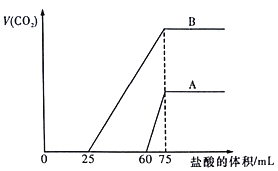
A. B曲线中消耗盐酸0<V(HCl)<25mL时发生的离子反应为: OH-+H+=H2O,H++CO32-=HCO3-
B. 原NaOH溶液的物质的量浓度为0.75mol/L
C. B曲线最终产生的CO2体积(标准状况下)为112mL
D. 加盐酸之前A溶液中的溶质是碳酸钠和碳酸氢钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com