
【题目】《有机化学基础》
(1) 分子中的官能团与有机化合物的性质密切相关。
①下列化合物中与![]() 互为同系物的是____(填字母)。
互为同系物的是____(填字母)。
a. ![]() b.
b. ![]() c.
c. ![]()
②下列化合物中,常温下能使酸性高锰酸钾溶液褪色的是____(填字母)。
a. CH3CH3 b. HC≡CH c. CH3COOH
③下列化合物中,能发生酯化反应的是____(填字母)。
a. CH3CH2Cl b. CH3CHO c. CH3CH2OH
(2) 化合物X(![]() )是一种合成液晶材料的化工原料。
)是一种合成液晶材料的化工原料。
①1 mol X在一定条件下最多能与____mol H2发生加成反应。
②X在酸性条件下水解可生成![]() 和________(用结构简式表示)。
和________(用结构简式表示)。
③![]() 分子中最多有____个碳原子共平面。
分子中最多有____个碳原子共平面。
(3) 化合物D是一种医药中间体,可通过下列方法合成。
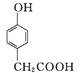 A
A![]()
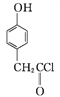 B
B ![]()
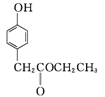 C
C ![]()
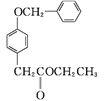 D
D
①A→B的反应类型为____。
②D中含氧官能团有____和____(填名称)。
③C→D的反应中有HCl生成,则M的结构简式为_______。
④E是A的一种同分异构体,E分子的核磁共振氢谱共有4个吸收峰,能发生银镜反应,能与FeCl3溶液发生显色反应。E的结构简式为___________(任写一种)。
【答案】 c b c 4 ![]() 8 取代反应 酯基 醚键
8 取代反应 酯基 醚键 ![]()
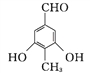 或
或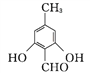
【解析】(1)①![]() 为苯酚,属于酚,a.
为苯酚,属于酚,a. ![]() 属于醇,虽然比苯酚多一个CH2,但不互为同系物,故不选;b.
属于醇,虽然比苯酚多一个CH2,但不互为同系物,故不选;b. ![]() 属于醚,虽然比苯酚多一个CH2,但不互为同系物,故不选;c.
属于醚,虽然比苯酚多一个CH2,但不互为同系物,故不选;c. ![]() 属于酚,比苯酚多一个CH2,互为同系物,故选;答案选c;②a. CH3CH3性质较稳定,和酸性高锰酸钾溶液不反应,则乙烷不能使酸性高锰酸钾溶液褪色,故不选;b. HC≡CH含有碳碳三键,所以能被酸性高锰酸钾溶液氧化,则乙炔能使酸性高锰酸钾溶液褪色,故选;c. CH3COOH性质较稳定且没有还原性,则乙酸不能使酸性高锰酸钾溶液褪色,故不选;答案选b;③能发生酯化反应的有醇和羧酸,a. CH3CH2Cl为卤代烃,不能发生酯化反应,故不选;b. CH3CHO为醛,不能发生酯化反应,故不选;c. CH3CH2OH为醇,能发生酯化反应,故选;答案选c;(2) ①化合物X(
属于酚,比苯酚多一个CH2,互为同系物,故选;答案选c;②a. CH3CH3性质较稳定,和酸性高锰酸钾溶液不反应,则乙烷不能使酸性高锰酸钾溶液褪色,故不选;b. HC≡CH含有碳碳三键,所以能被酸性高锰酸钾溶液氧化,则乙炔能使酸性高锰酸钾溶液褪色,故选;c. CH3COOH性质较稳定且没有还原性,则乙酸不能使酸性高锰酸钾溶液褪色,故不选;答案选b;③能发生酯化反应的有醇和羧酸,a. CH3CH2Cl为卤代烃,不能发生酯化反应,故不选;b. CH3CHO为醛,不能发生酯化反应,故不选;c. CH3CH2OH为醇,能发生酯化反应,故选;答案选c;(2) ①化合物X(![]() )中含有一个苯环和一个羰基,1 mol X在一定条件下最多能与4mol H2发生加成反应;②X在酸性条件下水解可生成
)中含有一个苯环和一个羰基,1 mol X在一定条件下最多能与4mol H2发生加成反应;②X在酸性条件下水解可生成![]() 和2-甲基丙酸,结构简式为
和2-甲基丙酸,结构简式为![]() ;③根据苯分子中12个原子共面及甲醛分子中4个原子共面可知,
;③根据苯分子中12个原子共面及甲醛分子中4个原子共面可知,![]() 分子中最多有8个碳原子共平面;(3) ①A→B是
分子中最多有8个碳原子共平面;(3) ①A→B是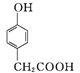 与SOCl2反应生成
与SOCl2反应生成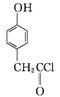 SO2、和HCl,反应类型为取代反应;②
SO2、和HCl,反应类型为取代反应;②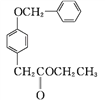 中含氧官能团有酯基和醚键;③结合
中含氧官能团有酯基和醚键;③结合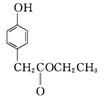 、
、 的结构简式,由C→D的反应中有HCl生成,则应该是发生取代反应,M的结构简式为
的结构简式,由C→D的反应中有HCl生成,则应该是发生取代反应,M的结构简式为![]() ;④E是
;④E是 的一种同分异构体,E分子的核磁共振氢谱共有4个吸收峰,则分子高度对称,能发生银镜反应则含有醛基,能与FeCl3溶液发生显色反应则含有酚羟基。故符合条件的E的结构简式为
的一种同分异构体,E分子的核磁共振氢谱共有4个吸收峰,则分子高度对称,能发生银镜反应则含有醛基,能与FeCl3溶液发生显色反应则含有酚羟基。故符合条件的E的结构简式为  或
或 。
。


科目:高中化学 来源: 题型:
【题目】关于常温下pH=3的CH3COOH溶液,下列叙述不正确的是( )
A. c(H+)= c(CH3COO-)+ c(OH-)
B. 加入少量CH3COONa固体后,c(CH3COO-)降低
C. 该溶液中由水电离出的c(H+)是1.0×10-11mol/L
D. 与等体积pH =11的NaOH溶液混合后溶液显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】摩尔盐[(NH4)2Fe(SO4)2·6H2O]是一种重要的化工原料,可用于制取纳米Fe3O4和草酸合铁酸钾等。
(1)取一定质量摩尔盐样品与过量NaOH溶液反应。
①根据生成气体的体积计算得到摩尔盐的纯度小于实际值,其原因是______。
②向所得Fe(OH)2沉淀中加入NaNO2溶液可制得纳米Fe3O4,同时产生NO。该反应的离子方程式为______。
(2)摩尔盐经氧化后与KOH和H2C2O4反应可得到草酸合铁酸钾[KaFeb(C2O4)c·dH2O],其中Fe元素化合价为+3。
①已知25 ℃,H2C2O4的电离常数Ka1=5.6×10-2,Ka2=5.4×10-5。pH=4的H2C2O4溶液中c(C2O![]() ):c(HC2O)=______。
):c(HC2O)=______。
②为了确定草酸合铁酸钾的组成,准确称取4.910 g样品在氮气气氛下加热,固体样品的剩余质量随温度的变化如图所示。
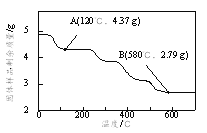
已知:a.120℃时已完全失去结晶水。
b.200℃~580℃分解产生的CO和CO2恢复至标准状况下体积为1.008 L。
c.580℃以上残留固体为FeO和K2CO3的混合物。
根据以上实验数据计算草酸合铁酸钾中的n(Fe3+):n(C2O42-)_____________(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质:①氢氧化钠溶液、②铜片、③碳酸钙、④蔗糖、⑤熔融的NaCl、⑥SO2气体、⑦碳酸氢钠、⑧盐酸
(1)能导电且属于电解质的是___________。(填编号)
(2)写出碳酸钙的电离方程式____________________________________。
(3)写出碳酸氢钠与氢氧化钠反应的离子方程式____________________________________。
(4)向100mL1.5mol/L的氢氧化钠溶液中缓慢通入一定量的CO2,反应后,向所得溶液中逐滴缓慢滴加一定浓度的盐酸,所得气体的体积与所加盐酸的体积(不考虑气体溶解于水)关系如图所示。
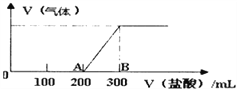
则
①氢氧化钠溶液与一定量的CO2充分反应后的溶液中溶质为_________(写化学式)。
②盐酸的浓度为________________________。
③B点时,产生的气体在标准状况下的体积为_________________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为光伏发电电解甲基肼[CH3-NH-NH2]制氢的装置示意图(电解池中交换膜仅阻止气体通过,a、b极均为惰性电极)。下列叙述中正确的是
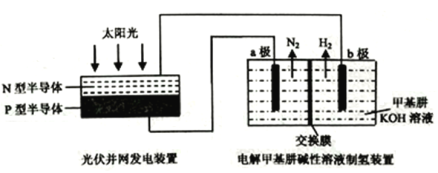
A. N型半导体为正极,P型半导体为负极
B. 制氢装置溶液中电子从a极流向b极
C. 工作时,产生的N2、H2体积比为1:3(同温同压)
D. 工作时,a极的电极反应式为CH3-NH-NH2+12OHˉ-10eˉ=CO32-+N2↑+9H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法正确的是( )
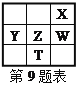
A. X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增
B. Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增
C. YX2晶体熔化、液态WX3气化均需克服分子间作用力
D. 根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如下左图所示,根据判断出的元素回答问题:

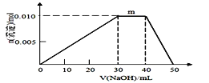
⑴ f在元素周期表的位置是__________。
⑵ 比较d、e常见离子的半径的小(用化学式表示,下同)_______>__________比较g、h的最高价氧化物对应的水化物的酸性强弱是:_______>__________
⑶ 任选上述元素组成一种四原子共价化合物,写出其电子式____________________
⑷ 已知1mole的单质在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式____________
⑸ 上述元素可组成盐R:zx4f(gd4)2,向盛有10mL1mol·L-1R溶液的烧杯中滴加1mol·L-1NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如上右图所示:
① R溶液中离子浓度由大到小的顺序是________________
② 写出m点反应的而离子方程式________________________________
③ 若R溶液改加20mL1.2 mol·L-1Ba(OH)2溶液,充分中产生沉淀的物质的量为_______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)
A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B 在D中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A在F中燃烧,产物溶于水得到一种强酸。回答下列问题:
(1)A在周期表中的位置是 ,写出一种工业制备单质F的离子方程式 。
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为 ,其水溶液与F单质反应的化学方程式为 ;在产物中加入少量KI,反应后加人CC14并振荡,有 机层显 色。
(3)由这些元素组成的物质,其组成和结构信息如下表:
物质 | 组成和结构信息 |
a | 含有A的二元离子化合物 |
b | 含有非极性共价键的二元离子化合物,且原子数之比为1:1 |
c | 化学组成为BDF2 |
d | 只存在一种类型作用力且可导电的单质晶体 |
a的化学式为 ;b的化学式为 ;;c的电子式为 ;
d的晶体类型是 。
(4)由A和B、D元素组成的两种二元化合物形成一类新能源物质。一种化合物分子通过 键构成具有空腔的固体;另一种化合物(沼气的主要成分)分子进入该空腔,其分子的空间结构为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铝用途广泛,工业上利用铝矾土矿(主要成分是Al2O3)制备金属铝。
(1)首先获得纯净的Al2O3,其工艺流程如下:
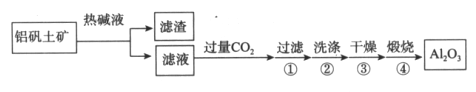
①滤液中通入过量CO2的反应离子方程式是________________。
②煅烧生成氧化铝的化学方程式是______________。
(2)将Al2O3溶解于熔融的冰晶石(助熔剂)中,以石墨衬里为阴极,石墨棒为阳极,进行电解。
①电解Al2O3能制备金属铝的原因是__________(填序号)。
a. Al2O3属于电解质
b. Al2O3属于离子化合物
c. Al2O3属于两性氧化物
d. Al2O3在熔融状态时能导电
②Al单质在_________极产生。
③阳极石墨棒需要不断补充,结合电极反应式,简述其原因是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com