
【题目】(15分)
A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B 在D中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A在F中燃烧,产物溶于水得到一种强酸。回答下列问题:
(1)A在周期表中的位置是 ,写出一种工业制备单质F的离子方程式 。
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为 ,其水溶液与F单质反应的化学方程式为 ;在产物中加入少量KI,反应后加人CC14并振荡,有 机层显 色。
(3)由这些元素组成的物质,其组成和结构信息如下表:
物质 | 组成和结构信息 |
a | 含有A的二元离子化合物 |
b | 含有非极性共价键的二元离子化合物,且原子数之比为1:1 |
c | 化学组成为BDF2 |
d | 只存在一种类型作用力且可导电的单质晶体 |
a的化学式为 ;b的化学式为 ;;c的电子式为 ;
d的晶体类型是 。
(4)由A和B、D元素组成的两种二元化合物形成一类新能源物质。一种化合物分子通过 键构成具有空腔的固体;另一种化合物(沼气的主要成分)分子进入该空腔,其分子的空间结构为 。
【答案】
⑴第一周期IA族 2Cl- +2H2O![]() 2OH- +H2↑+C12↑(或2NaCl(熔融)
2OH- +H2↑+C12↑(或2NaCl(熔融)![]() 2Na+Cl2。↑(每空2分)
2Na+Cl2。↑(每空2分)
⑵纯碱(或苏打)(1分) 2Na2CO3+Cl2+H2O = NaClO+NaCl+2NaHCO3( 2分)紫(1分)
⑶NaH (1分) Na2〇2和Na2C2 ( 2分) 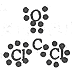 (1分) 金属晶体(1分)
(1分) 金属晶体(1分)
⑷氢(1分)正四面体(1分)
【解析】
试题根据“非金属元素A最外层电子数与其周期数相同”确定A为氢元素,然后根据其它信息推出B为碳元素,D为氧元素,E为钠元素,F为氯元素。
⑴H在周期表中的位置为第一周期IA族;工业制备上Cl2的原理有电解饱和食盐水或电解熔融的NaCl,据此便可写出其相应的离子方程式。
⑵C、O、Na组成的一种盐中,满足E的质量分数为43%的盐为Na2CO3,俗称纯碱或苏打;其水溶液与Cl2反应,可理解为Cl2先与水反应有HCl和HClO,Na2CO3水解有NaHCO3和NaOH,二者再反应,可确定其生成物有NaClO 、NaCl 、NaHCO3,然后通过氧化还原反应的配平方法将其配平;在产物中加入少量KI,NaClO将KI氧化生成I2,反应后加人CC14并振荡溶液显紫色。
⑶在这些元素中只有Na才与H形成二元离子化合物NaH(a的化学式);形成含有非极性共价键的二元离子化合物,且原子数之比为1:1的物质有Na2〇2和Na2C2(b的化学式);BDF2的化学式为COCl2,其结构式为![]() ,据此便可写出其电子式
,据此便可写出其电子式 ;只存在一种类型作用力且可导电的单质晶体为金属钠,属于金属晶体。
;只存在一种类型作用力且可导电的单质晶体为金属钠,属于金属晶体。
⑷由H和C、O元素组成的两种二元化合物CH4、H2O能形成一类新能源物质,一种化合物分子(H2O)通过氢键构成具有空腔的固体;另一种化合物(沼气的主要成分CH4)分子进入该空腔,CH4分子的空间结构为正四面体结构。


 每课必练系列答案
每课必练系列答案科目:高中化学 来源: 题型:
【题目】氧化还原反应是中学化学中常见且重要的一类反应,回答下列问题:
(1)下列金属单质参加的化学反应都是氧化还原反应,都是金属失电子。
①相同质量的钠分别与氧气反应,全部生成氧化钠和全部生成过氧化钠两种情况下转移的电子数目之比是________;
②分别取W克钠、铁、铝与足量的盐酸反应,失去电子的物质的量之比是________;③分别取含0.1mol H2SO4的稀硫酸和含0.1mol NaOH的氢氧化钠溶液于两支试管中,分别加入足量的铝粉充分反应,产生氢气 (同温同压下)的体积之比是________。
(2)某氧化还原反应的反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。
已知该反应中H2O2转化为氧气。
①该反应中的还原剂是____________;
②如果化学方程式中Cr(OH)3和H2O2的物质的量之比为2:3,写出该反应的化学方程式,并标出电子转移的方向和数目_________________;
③如果反应中转移了3a mol电子,则产生的气体在标准状况下体积为______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《有机化学基础》
(1) 分子中的官能团与有机化合物的性质密切相关。
①下列化合物中与![]() 互为同系物的是____(填字母)。
互为同系物的是____(填字母)。
a. ![]() b.
b. ![]() c.
c. ![]()
②下列化合物中,常温下能使酸性高锰酸钾溶液褪色的是____(填字母)。
a. CH3CH3 b. HC≡CH c. CH3COOH
③下列化合物中,能发生酯化反应的是____(填字母)。
a. CH3CH2Cl b. CH3CHO c. CH3CH2OH
(2) 化合物X(![]() )是一种合成液晶材料的化工原料。
)是一种合成液晶材料的化工原料。
①1 mol X在一定条件下最多能与____mol H2发生加成反应。
②X在酸性条件下水解可生成![]() 和________(用结构简式表示)。
和________(用结构简式表示)。
③![]() 分子中最多有____个碳原子共平面。
分子中最多有____个碳原子共平面。
(3) 化合物D是一种医药中间体,可通过下列方法合成。
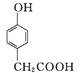 A
A![]()
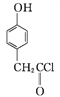 B
B ![]()
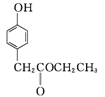 C
C ![]()
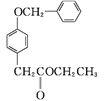 D
D
①A→B的反应类型为____。
②D中含氧官能团有____和____(填名称)。
③C→D的反应中有HCl生成,则M的结构简式为_______。
④E是A的一种同分异构体,E分子的核磁共振氢谱共有4个吸收峰,能发生银镜反应,能与FeCl3溶液发生显色反应。E的结构简式为___________(任写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮、氧、氯、钠、铜等元素的化合物广泛存在于自然界,回答下列问题:
(1)基态氯原子的价电子排布图是________________________;基态铜原子核外电子占有的空间运动状态有____________种
(2)碳、氮、氧三种元素中第一电离能最大的是____________ (填元素符号)CO32-中碳原子的杂化轨道类型为____________。
(3)相同条件下,水的沸点高于液氨,原因是________________________。
(4)铜与CNˉ可形成络合离子[Cu(CNˉ)4]2-,写出一种与CNˉ互为等电子体的分子的化学式____________;1 mol[ Cu(CNˉ)4]2-中含有____________molσ键;若将[Cu(CNˉ)4]2-中二个CNˉ换为Clˉ,只有一种结构,则[Cu(CNˉ)4]2-中4个氮原子所处空间位置关系为_________。
(5)氯化钠的晶胞如图所示。晶体中氯离子以面心立方最密堆积排列,钠离子嵌入在氯离子之间的空隙中。一个氯离子周围离氯离子最近的氯离子数目为__________个。已知:半径r(Clˉ)=apm,r(Na+)=bpm。摩尔质量M(NaCI)=cg·mol-1则氯化钠晶体的密度为_________g·cm-3

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于说法正确的是( )
A. HCl和NaOH反应的中和热△H=﹣57.3 kJ/mol。则H2SO4和Ba(OH)2反应的中和热△H=2×(﹣57.3) kJ/mol
B. 已知C2H5OH(l)的燃烧热是1366.8 kJ/mol,则C2H5OH(l)+3O2(g) ═ 2CO2(g)+3H2O(g) 反应的△H=-1366.8 kJ/mol
C. 一定条件下2SO2(g)+O2(g)![]() 2SO3(g) △H1<0,2SO2(g)+O2(g)
2SO3(g) △H1<0,2SO2(g)+O2(g)![]() 2SO3(l) △H2<0,则△H1>△H2
2SO3(l) △H2<0,则△H1>△H2
D. 在一定温度和压强下,将0.5mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放出热量19.3 kJ,则其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) △H=﹣38.6kJ/mol
2NH3(g) △H=﹣38.6kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学上常用AG表示溶液中的lg 。25℃时,用0.100 molL-1的NaOH溶液滴定20.00 mL 0.100 molL-1的HNO2溶液,AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法正确的是
。25℃时,用0.100 molL-1的NaOH溶液滴定20.00 mL 0.100 molL-1的HNO2溶液,AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法正确的是

A. D点溶液的pH = 11.25
B. B点溶液中存在 c(H+)-c(OH-)=c(NO2-)-c(HNO2)
C. C点时,加入NaOH溶液的体积为20 mL
D. 25℃时,HNO2的电离常数Ka=1.0×10-5.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以乙醇为原料经一系列反应可以得到4羟基扁桃酸和香豆素3羧酸,二者的合成路线如下(部分产物及条件未列出):
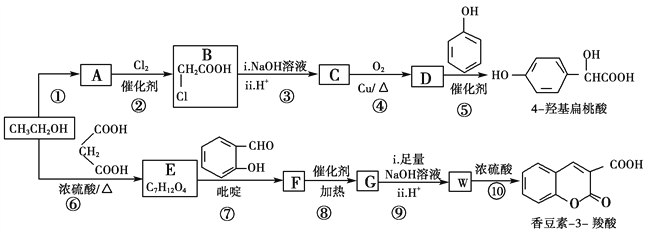
已知:
Ⅰ.RCOOR′+R″OH![]() RCOOR″+R′OH
RCOOR″+R′OH
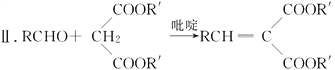
(R,R′,R″表示氢原子、烷基或芳基)
回答下列问题:
(1)反应②属于取代反应,则A中官能团的名称是________
(2)  的名称是________,反应⑤的反应类型为________。
的名称是________,反应⑤的反应类型为________。
(3)反应⑥的化学方程式是________________________________________。
(4)已知G分子中含有2个六元环。下列有关说法正确的是________(填标号)。
a.核磁共振仪可测出E有5种类型的氢原子
b.质谱仪可检测F的最大质荷比的值为236
c. G分子中的碳原子均可以共面
d.化合物W能发生加聚反应得到线型高分子化合物
(5)某芳香化合物Q是4羟基扁桃酸的同分异构体,具有下列特征:①苯环上只有3个取代基;②能发生水解反应和银镜反应;③1 mol Q最多能消耗3 mol NaOH。Q共有________种(不含立体异构)
(6)仔细观察由乙醇合成香豆素-3-羧酸的过程,结合相关信息,当乙醇与丙二酸的物质的量的比为_______时,只许3步即可完成合成路线。请写出合成路线_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,置入一定量的NO和足量C发生化学反应:C(s)+2NO(g)![]() CO2(g)+N2(g),平衡时c(NO)与温度T的关系如图所示,则下列说法正确的是
CO2(g)+N2(g),平衡时c(NO)与温度T的关系如图所示,则下列说法正确的是

A. 增大压强或升高温度,NO转化率均增大
B. 若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2
C. 在T2时,若反应体系处于状态D,则此时v正>v逆
D. 若状态B、C、D的压强分别为PB、PC、PD,则PC=PD>PB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NiCl2是化工合成中最重要的镍源。实验室常用下列装置(夹持装置已略去)制备无水NiCl2。
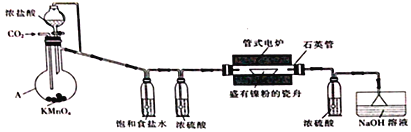
实验步骤如下:
I.按图示连接好装置,检查装置气密性后,先向装置中通入干燥的CO2。
II.约20min后,停止通入CO2,改为通儒Cl2并使装置中充满Cl2。
III.将电炉升温至750℃,在氯气流中加热约lh。
IV.在氯气流中冷却至室温后,再继续通入CO2约10min。
回答下列问题:
(1)仪器A的名称为_____________________________。
(2)步骤I中通入CO2的目的是___________________________。
(3)A中生成Cl2的离子方程式为______________________________________。
(4)判断步骤II中氧气已充满装置的现象是______________________________________。
(5)步骤IV中通入CO2的目的是______________,水槽中NaOH溶液的作用是_____________________。
(6)反应前石英管及瓷舟的总质量为m1、放入镍粉后石英管及瓷舟的总质量为m2,氧化反应后石英管及瓷舟的总质量为m3,则产品中n(Ni)/n(Cl)=________(填计算表达式)。
(7)实验室也可用NiCl2·6H2O与液态SOCl2混合加热制取无水NiCl2,其反应的化学方程式为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com